Εισαγωγικές έννοιες.
Η επιστήμη επιφανειών είναι κλάδος της επιστήμης υλικών που επικεντρώνεται σε φυσικά και χημικά φαινόμενα που συμβαίνουν στις επιφάνειες στερεών υλικών. Παραδείγματα φυσικών φαινομένων που έχουν αισθητή διαφορά μεταξύ επιφάνειας και εσωτερικού (bulk) του υλικού είναι η αυξημένη αλληλεπίδραση με το φως, το χαμηλότερο σημείο τήξης, η μαλακότερη ύλη, οι εντοπισμένες ηλεκτρονιακές καταστάσεις. Παραδείγματα χημικών φαινομένων είναι η ηλεκτροχημεία, η κατάλυση, η οξείδωση των μετάλλων. Όλα τα παραπάνω φαινόμενα έχουν μια κοινή αφετηρία: την ύπαρξη ανοιχτών δεσμών (dangling bonds) στα επιφανειακά άτομα.
Ας πάρουμε για παράδειγμα τον Fe. O Fe στην κατάσταση χαμηλότερης ενέργειας σχηματίζει δομή bcc όπου κάθε άτομο Fe συνδέεται με 8 γείτονες: λέμε ότι έχει αριθμό σύνταξης z=8. Αν φανταστούμε ότι κόβουμε ένα κομμάτι Fe παράλληλα σε ένα επίπεδο συμμετρίας της bcc, θα δημιουρφηθούν δυο επιφάνειες όπου τα άτομα έχουν z=4. Οι 4 ανοιχτοί δεσμοί που δημιουργούνται θα προκαλέσουν αστάθεια στην επιφάνεια, άρα τα επιφανειακά άτομα δεν είναι σε κατάσταση χαμηλότερης ενέργειας και είναι πιο εύκολο να επηρεαστούν από εξωτερικά ηλεκτρικά πεδία, μηχανικές παραμορφώσεις κλπ. Επίσης, τα μονήρη ηλεκτρόνια που προκύπτουν θα προκαλέσουν πολύ έντονη χημική συμπεριφορά, καθώς θα αντιδράσουν πολύ εύκολα και εξώθερμα με όποιο μόριο βρεθεί δίπλα τους.
Νανοσωματίδια είναι κομμάτια υλικών που έχουν διαστάσεις μερικών nm. Νανοϋλικό είναι ένα υλικό που περιέχει νανοσωματίδια, και που οι ιδιότητές του διαφέρουν αισθητά από αυτές των συστατικών του. Παραδείγματα νανοϋλικών είναι οι καταλύτες (μεταλλικά νανοσωματίδια σε κεραμικό υπόστρωμα), πολλά μεταλλικά χρώματα (νανοσωματίδια οξειδίων σε πολυμερή), φάρμακα, και στοιχεία ηλεκτρονικών (νανοσωματίδια ημιαγωγών σε υπόστρωμα ημιαγωγών), φωτοβολταϊκά και άλλα.
Η σχέση μεταξύ επιφανειών και νανοϋλικών βρίσκεται στο ότι τα νανοϋλικά έχουν τεράστια επιφάνεια σε σχέση με τα κοινά υλικά και οι ιδιότητές τους συχνά εξηγούνται με όρους επιστήμης επιφανειών.
Οι βασικές φυσικές ιδιότητες που χαρακτηρίζουν τα νανοϋλικά
Τα νανοσωματίδια έχουν τεράστια ειδική επιφάνεια
Τα νανοσωματίδια έχουν πολύ μεγάλη ειδική επιφάνεια (εμβαδόν ανά μονάδα μάζας) και συγκέντρωση επιφανειακών ατόμων (επιφανεικά άτομα ανά συνολικά άτομα) σε σχέση με τα συνηθισμένα μεγέθη ύλης που αντιλαμβανόμαστε με τις αισθήσεις μας.
Παράδειγμα 1: Υπολογίστε την ειδική επιφάνεια κύβου ακμής L. Δείξτε ότι για L=1 cm έχει ειδική επιφάνεια της τάξης του 10-5 m2/g ενώ για L=1 nm (νανοσωματίδιο) έχει ειδική επιφάνεια της τάξης του 102 m2/g.
Παράδειγμα 2: Υπολογίστε την συγκέντρωση επιφανειακών ατόμων σε κύβο ακμής L o οποίος περιέχει άτομα σε απλή κυβική δομή. Δείξτε ότι για τυικό μέταλλο η συγκέντρωση είναι σχεδόν 0 για L > 1 μm ενώ αγγίζει το 100% για νανοσωματίδιο.
Σε οποιοδήποτε κυρτό στερεό σώμα πλευράς a, η επιφάνεια είναι ανάλογη του a2 και ο όγκος ανάλογος του a3, κοι οι συντελεστές αναλογίας είναι συνήθως της ίδιας τάξης μεγέθους (δείτε πχ τα σχήματα στις ασκήσεις άσκηση 47 και 48). Επομένως τα παραπάνω αποτελέσματα που βρέθηκαν για κύβο ισχύουν κατά προσέγγιση σε όλα τα νανοϋλικά.
Εργασία 1: άσκηση 7 και 8.
Εισαγωγή στην νανοητεχνολογία
Η ομιλία του Richard Feynmann, "There's Plenty of Room at the Bottom", το 1959, γέννησε τον σύχρονο κλάδο της νανοτεχνολογίας. Την εποχή εκείνη, η αποθήκευση αριθμών γινόταν σε μαγνητικές ταινίες (αποθήκευση 10-100 αριθμών ανά cm2) και η αποθήκευση κειμένου και εικόνων σε μικροφίλμ (περίπου 1 σελίδα ανά cm2). Ο Feynmann υποστήριξε ότι δεν υπήρχε κανένας νόμος της φύσης που να απαγορεύει αποθήκευση δεδομένων σε πυκνότητες με πολλές τάξεις μεγέθους. Το παράδειγμα που έδωσε ήταν η σμίκρυνση μιας ολόκληρης εγκυκλοπαίδειας ώστε να χωράει στο κεφάλι μιας καρφίτσας. Εύκολα δείχνει κανείς ότι η τάξη μεγέθους της σμίκρυνσης (zoom out) που απαιτείται είναι 1:10000, η οποία επιτυγχάνεται εύκολα. Σε αυτή τη σμίκρυνση, η μικρότερη κουκίδα της εγκυκλοπαίδειας θα καταλαμβάνει χώρο περίπου 10000 ατόμων, το οποίο επίσης είναι γενικά εφικτό.
Στην σημερινή εποχή η εγγραφή γίνεται ψηφιακά: τα κείμενα και οι εικόνες μετατρέπονται σε μια σειρά αριθμών, οι αριθμοί μετατρέπονται στο δυαδικό σύστημα και έτσι η πληροφορία γίνεται μια τεράστια σειρά από 0 και 1. Τα ψηφία 0 και 1 λέγονται bit. Μια σειρά από bit που σχηματίζει έναν αριμό λέγεται byte. To ένα byte περιέχει 8, 16, 32 ή 64 bit, ανάλογα με το σύστημα. Στη συνέχεια, το υλικό εγγραφής χωρίζεται σε μικρές περιοχές. Η κάθε περιοχή υφίσταται μια αναστρέψιμη μεταβολή (πχ μαγνητίζεται) οπότε φέρει τον αριθμό 1 ή δεν υφίσταται την μεταβολή οπότε φέρει τον αριθμό 0. Για την ανάγνωση των δεδομένων, η συσκευή ανάγνωσης βλέπει αν μια συγκεκριμένη περιοχή έχει ή δεν έχει την μεταβολή, οπότε διαβάζει ανάλογα το ψηφίο 1 ή 0 αντίστοιχα.
Ένα μέτρο της πυκνότητας εγγραφής είναι ο μέσος αριθμός ατόμων στην επιφάνεια του υλικού στα οποία εγγράφεται 1 bit πληροφορίας. Όσο πιο μικρός ο αριθμός, τόσο πιο πολλά δεδομένα χωράει η συσκευή μας.
Σε ένα usb stick των 100GB με επιφάνεια της τάξης του 1 cm2 και για τυπικό εμβαδόν ατόμου 10 Å2, βρίσκουμε πυκνότητα 1 bit ανά 10000 άτομα, δηλαδή η σημερινή τεχνολογία μόλις έφτασε στα όρια που οραματίστηκε ο Feynmann.
Η εξέλιξης της νανοηλεκτρονικής περιγράφεται από τον εμπειρικό νόμο του Moore, σύμφωνα με τον οποίο o αριθμός των τρανζίστορ που περιέχονται σε ένα ολοκληρωμένο κύκλωμα διπλασιάζεται κάθε περίπου δυο χρόνια. Αντίστοιχοι κανόνες έχουν βρεθεί για την ταχύτητα των επεξεργαστών, την χωρητικότητα των σκληρών δίσκων κλπ. Μαθηματικά, ο νόμος του Moore περιγράφεται από την συνάρτηση N(t)=N02t/τ όπου t είναι ο χρόνος και τ o χρόνος στον οποίο διπλασιάζεται το N.
Εργασία 2: άσκηση 2 και 5.
Υπενθυμίζεται ότι η προθεσμία για παράδοση των εργασιών 1 και 2 είναι η 5/3/2015. Από την εργασία 3 και έπειτα, οι εργασίες πρέπει να παραδίδονται εντός μιας εβδομάδας.Κυκλώματα ενός ηλεκτρονίου
Η σμίκρυνση που χρησιμοποιείται σήμερα στα ηλεκτρονικά έχει αλλάξει τελείως τον σχεδιασμό και την λειτουργία των ηλεκτρικών κυκλωμάτων. Το πιο σημαντικό φαινόμενο σε αυτή την κατηγορία είναι η φραγή Coulomb: σε ένα νανοσύστημα απαιτείται τεράστια ενέργεια για να προστεθεί ακόμα και το μικρότερο φορτίο, που είναι ένα ηλεκτρόνιο. Το φαινόμενο παρατηρήθηκε το 1968 από τους Giaever και Zeller. Για αυτό μιλάμε σήμερα για κυκλώματα ενός ηλεκτρονίου, όπου το ρεύμα και η τάση στο κύκλωμα προκαλούνται από την κίνηση ενός (ή έστω λίγων) ηλεκτρονίων. Θα μελετήσουμε την φραγή Coulomb με δυο τρόπους: με κλασσικό ηλεκτρομαγνητισμό και με κβαντομηχανική.
Κλασσικά, το πόσο φορτίζεται ένα σώμα σε ηλεκτρικό πεδίο περιγράφεται από την χωρητικότητά του, C. Θυμόμαστε από τη γενική Φυσική ότι η χωρητικότητα επίπεδου πυκνωτή με εμβαδόν οπλισμών Α και απόσταση οπλισμών d είναι C=ε0A/d, και ότι η χωρητικότητα σφαίρας ακτίνας R είναι C=4πε0R. Δείτε στην wikipedia τους τύπους για μερικά ακόμα συστήματα. Γενικά, η διαστατική ανάλυση δίνει ότι C~ε0L, όπου L είναι κάποιο χαρακτηριστικό μήκος του συστήματος. Με βάση τον απλό αυτό τύπο, βλέπουμε ότι η χωρητικότητα είναι στην περιοχή των pF για L=1 mm, ενώ πέφτει 6 τάξεις μεγέθους για L=1 nm.
H ενέργεια που απαιτείται για να φορτιστεί ένα σύστημα με φορτίο Q είναι ανάλογη του Q2/C (στον επίπεδο πυκνωτή, η σταθερά αναλογίας είναι 1/2 ενώ στην σφαίρα είναι 1). Επομένως για το ελάχιστο δυνατό φορτίο Q=e, βρίσκουμε ότι η τάξη μεγέθους της ενέργειας φόρτισης είναι 1 eV για L=1nm και 1 μ eV για L=1mm. Επομένως (1) το νανοϋλικό είναι μονωτής σε μικρές τάσεις, αφού δεν μπορεί να περάσει ρεύμα αν δεν βάλουμε τάση τουλάχιστον 1 V. Αυτό είναι το κατ'εξοχήν χαρακτηριστικό των υλικών των τρανζίστορ. και (2) το νανοϋλικό είναι πάρα πολύ σταθερό σε αλλαγές της θερμοκρασίας, αφού η θερμική ενέργεια είναι μερικές δεκάδες meV. Επομένως ενώ e μπάινουν και βγαίνουν ελεύθερα λόγω θερμικής κίνησης σε ένα συνηθισμένο ηλεκτρονικό κύκλωμα, στο νανοηλεκτρονικό κύκλωμα δεν μπορεί να συμβεί αυτό. Και μάλιστα ο αριθμός των ηλεκτρονίων στο κύκλωμα είναι απόλυτα καθορισμένος, αφού πρόσθεση ή αφαίρεση έστω και ενός ηλεκτρονίου απαιτεί τεράστια ενέργεια.
H κβαντική φραγή Coulomb
Θεωρήστε νανοκαλώδιο μήκους L, και ένα ηλεκτρόνιο που κινείται ελεύθερα κατα μήκος του, αλλά δεν μπορεί να κινηθεί εκτός του καλωδίου. Λύστε την εξίσωση Schrodinger στο σύστημα και προσδιορίστε τις ιδιοενέργειες και τις ιδοσυναρτήσεις του ηλεκτρονίου. Δείτε πχ στο βιβλίο του Σ. Τραχανά, Κβαντομηχανική Ι, Ηράκλειο 2005, κεφ. 5, σελ. 217.
Θεωρήστε τώρα ότι έχουμε Ν ηλεκτρόνια στο καλωδιο. Ο αριθμός Ν μπορεί να εκτιμηθεί θεωρώντας ότι στην ύλη σε κάθε άτομο (διαμέτρου 0.2-0.3 nm) αντιστοιχούν 1-3 ηλεκτρόνια σθένους, άρα N/L είναι περίπου 10 nm-1. Εύκολα βρίσκει κανείς ότι το ενεργειακό χάσμα είναι αντιστρόφως ανάλογο του L, και έχει τιμή πρακτικά μηδέν για L=1 mm ενώ είναι της τάξης τους 1 eV για L=1 nm.
To χάσμα αυτό δίνει μια εκτίμηση της ενέργειας που απαιτείται για να προστεθεί ή να αφαιρεθεί ένα ηλεκτρόνιο από το σύστημα. Εφαρμογές στο νανοτρανζίστορ (το link ανοίγει μόνο από το Π.Κ.).
Οι ενέργειες αυτές είναι πολύ μεγαλύτερες από τη θερμική ενέργεια (kT). Το φαινόμενο αυτό λέγεται κβαντική φραγή Coulomb. Στο προηγούμενο μάθημα είδαμε το κλασσικό ανάλογο, που είναι η φόρτιση μεταλλικού σώματος με το ελάχιστο φορτίο, e. Η ενέργεια φόρτισης γίνεται πολύ μεγαλύτερη του kT όταν το μέγεθος πέσει στην περιοχή του nm.
Διάβασμα: Hanson κεφ. 7.1.1, 7.2, 7.3.3, 4.3, 4.4, Atkins-de Paula κεγ. 8.1, 8.2,
Εργασία 3: άσκηση 16 και 18.
Υπενθυμίζεται η προθεσμία παράδοσης των εργασιών 1-3 που είναι το βράδυ της Πέμπτης 5/3/15. Μπορείτε να τις ρίχνετε κάτω από την πόρτα του γραφείου μου αν δεν με βρείτε.
Διευκρινήσεις για τις ασκήσεις (με βάση απορίες που ρωτήθηκαν):
- 5: Πάρτε μια εύλογη εκτμίμηση για το εμβαδόν του σκληρού δίσκου. Θεωρήστε ότι το εμβαδόν ενός σκληρού δίσκου είναι κατά προσέγγιση το ίδιο από το 1980 έως σήμερα.
- 7: Στο 2. θεωρήστε ένα οποιοδήποτε σχήμα για την κάτοψη του φύλλου (πχ τετράγωνο ή κύκλος). Θα πρέπει το αποτέλεσμα να βγεί ίδιο, ανεξάρτητα από το σχήμα. Αγνοήστε το εμβαδόν της παράπλευρης επιφάνειας του φύλλου.
- 8: Φτιάξτε ένα πίνακα με τιμές των V, A, D, d, L, S για πέντε διαφορετικά στερεά. Σκοπός της άσκησης είναι να δείτε ότι οι τιμές των L, S έχουν κοντινές τιμές και ίδια τάξη μεγέθους για τα διάφορα νανοσωματίδια.
Καθώς στα νανοϋλικά οι αποστάσεις μεταξύ ενεργειακών επιπέδων είναι πολύ μεγαλύτερες από την θερμική ενέργεια, kT, ο πιο πρόσφορος τρόπος διέγερσης ηλεκτρονίων είναι μέσω της αλληλεπίδρασης με ηλεκτρομαγνητική ακτινοβολία. Στην περίπτωση των νανοϋλικών οι ενέργειες διέγερσης είναι κοντά στις ενέργειες οπτικών φωτονίων. Δηλαδή τα νανοϋλικά απορροφούν ενέργεια στο ορατό φως.
Άσκηση: νανοκαλώδιο Au έχει μήκος 30 nm και 3 ηλεκτρόνια σθένους ανά άτομο. Βρείτε το μέγιστο μήκος κύματος που μπορεί να έχει ακτινοβολία για να προκαλέσει διεγέρσεις ηλεκτρονίων στο νανοκαλώδιο.
Μια άλλη συνέπεια του γεγονότος ότι οι κβαντικές καταστάσεις στα νανοϋλικά έχουν ενέργειες της τάξης του eV, είναι ότι το μήκος κύματος de Broglie των ηλεκτρονίων προκύπτει της τάξης του nm. Έτσι σε ένα νανοϋλικό μπορούμε να αγνοούμε την κίνηση σε διαστάσεις με πάχος μικρότερο από μερικά nm. Για τον λόγο αυτό μιλάμε για υλικά 3,2,1 ή και 0 διαστάσεων, όπως στον πίνακα.
Συνοψίζοντας τα παραπάνω, όλες οι μoναδικές ιδιότητες των νανοϋλικών ανάγονται τελικά σε μια από τις παρακάτω τρεις βασικές ιδιότητες:
- Πολλά άτομα σε επιφάνειες σε σχέση με τα εσωτερικά άτομα.
- Η ενέργεια που απαιτείται για να προστεθεί ή να αφαιρεθεί ένα ηλεκτρόνιο είναι πολύ μεγαλύτερη της θερμικής ενέργειας kT.
- Κβαντισμένες στάθμες, με χάσματα συγκρίσιμα με τις ενέργειες οπτικών φωτονίων.
Ατομική δομή επιφανειών στερεών
Η δομή μιας επιφάνειας σε ατομική κλίμακα εξαρτάται από το είδος του υλικού, την κρυσταλλική δομή του και τον σχετικό προσανατολισμό της επιφάνειας ως προς τους άξονες συμμετρίας του κρυστάλλου. Το τελευταίο περιγράφεται από τους δείκτες Miller.
Δείτε τις ωραίες σελίδες του R. M. Nix (εδώ σημειώσεις για δείκτες Miller). Δείτε και τον surface explorer).
Άσκηση: Σχεδιάστε τις θέσεις των ατόμων στην επιφάνεια Fe(100). Aπάντηση.
Διάβασμα: Hanson κεφ. 9 (σελ 381-384, 408-413), Atkins-de Paula κεφ. 19.1, 19.2, Callister 3.8-3.9.
Εργασία 4 (παράδοση ως το πρωί της 16/3/15): άσκηση 12 και 13.
Παράταση στην παράδοση των εργασιών 1-3 ως το πρωί της Δευτέρας 9/3/15.
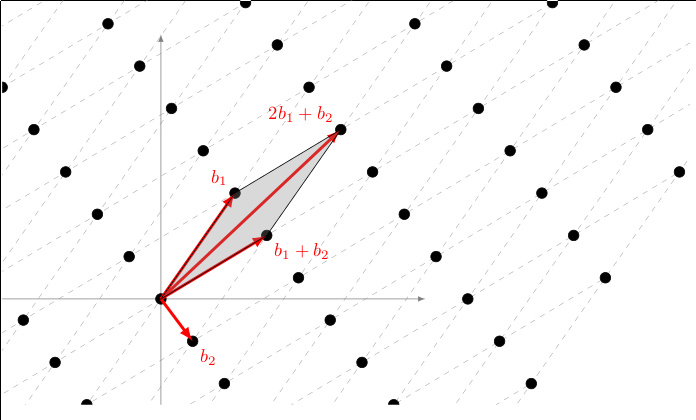 Τα a1 και a2 λέγονται διανύσματα βάσης, αν κάθε ζευγάρι ισοδύναμων ατόμων απέχει
R=n1a1+n1a2, όπου
n1 και n2 ακέραιοι. Τα διανύσματα βάσης δεν είναι μοναδικά. Για παράδειγμα, στην επιφάνεια Fe(100), ως διανύσματα βάσης μπορεί να θεωρηθεί το σύνολο { (α,0), (0,α)} ή το σύνολο { (-α,0), (0,α)}
ή το σύνολο { (α,α), (0,α)}. Μπορεί εύκολα να δείξει κανείς ότι όλα τα ισοδύναμα άτομα της επιφάνειας βρίσκονται σε θέσεις (κα,λα) όπου κ, λ ακέραιοι και ότι όλα τα διανύσματα που συνδέουν δυο άτομα γράφονται σαν ακέραιος γραμμικός συνδυασμός των a1 και a2.
Τα a1 και a2 λέγονται διανύσματα βάσης, αν κάθε ζευγάρι ισοδύναμων ατόμων απέχει
R=n1a1+n1a2, όπου
n1 και n2 ακέραιοι. Τα διανύσματα βάσης δεν είναι μοναδικά. Για παράδειγμα, στην επιφάνεια Fe(100), ως διανύσματα βάσης μπορεί να θεωρηθεί το σύνολο { (α,0), (0,α)} ή το σύνολο { (-α,0), (0,α)}
ή το σύνολο { (α,α), (0,α)}. Μπορεί εύκολα να δείξει κανείς ότι όλα τα ισοδύναμα άτομα της επιφάνειας βρίσκονται σε θέσεις (κα,λα) όπου κ, λ ακέραιοι και ότι όλα τα διανύσματα που συνδέουν δυο άτομα γράφονται σαν ακέραιος γραμμικός συνδυασμός των a1 και a2.
Νέες έννοιες:
- Τα a1 και a2 λέγονται διανύσματα βάσης, αν κάθε ζευγάρι ισοδύναμων ατόμων απέχει R=n1a1+n1a2, όπου n1 και n2 ακέραιοι. Τα διανύσματα βάσης δεν είναι μοναδικά.
- Θεμελιώδης κυψελίδα είναι το σχήμα που επαναλαμβανόμενο αυτούσιο παράγει όλη τη δομή χωρίς κενά και επικαλύψεις.
- Επιφανειακή συγκέντρωση, ns: αριθμός επιφανειακών ατόμων ανά μονάδα εμβαδού.
- Εμβαδόν ανά άτομο: το αντίστροφο της συγκέντρωσης.
- Πλήρωση, f: το ποσοστό του εμβαδού της επιφάνειας που καταλμβάνεται από άτομα, αν θεωρήσουμε ότι τα άτομα είναι σφαίρες με ακτίνα το μισό της μικρότερης διατομικής απόστασης.
- Επιφανειακή τάση: η ενέργεια ανά μονάδα εμβαδού που απαιτείται για το σχηματισμό της επιφάνειας.
Το μοντέλο των σπασμένων δεσμών (dangling bonds) εκφράζει την επιφανειακή τάση ως NdbEb/Α, όπου Ndb ο αριθμός των σπασμένων δεσμών σε μια περιοχή εμβαδού Α, και Eb η ενέργεια ανά δεσμό. Αυτή μπορεί να θεωρηθεί ότι ισούται με Ec/z, όπου Ec είναι η ενέργεια συνοχής ανά άτομο και z είναι ο αριθμός πλησιέστερων γειτόνων στον τέλειο κρύσταλλο.
Παράδειγμα: σε κρύσταλλο δομής bcc είναι z=8, άρα Edb=Ec/8. Στην (100) είναι Ndb=8-4=4 ακόρεστοι δεσμοί και το εμβαδόν ανά άτομο είναι a2, όπου a η πλεγματική σταθερά. Άρα γ=Ec/2a2.
Εύρεση θεμελιωδών κυψελίδων, διανυσμάτων βάσης, συγκέντρωσης, πλήρωσης και επιφανειακής τάσης για τις (100) της δομής fcc.
Εύρεση γεωμετρικής δομής, θεμελιωδών κυψελίδων, συγκέντρωσης και πλήρωσης για τις επιφάνειες μέγιστης πλήρωσης, fcc(111) και hcp(001).
Δείτε τις ωραίες σελίδες του R. M. Nix για τις δομές fcc, bcc, hcp.Διάβασμα: Atkins-de Paula κεφ. 18.1 (α), 19.1, 19.2, Callister 3.8-3.11.
Εργασία 5 (παράδοση ως το πρωί της 23/3/15): άσκηση 20 μόνο τις περιπτώσεις vi και vii.
Υποδείξεις για τις ασκήσεις 12 και 13 (με βάση απορίες που ρωτήθηκαν): Στην 12, πρέπει να βρείτε τις ενέργειες En στο μόριο, σύμφωνα με τον τύπο που ξέρετε. Ζητούνται 3 νούμερα για τις στάθμες 1) Fermi 2) την αμέσως ψηλότερη από την Fermi, και 3) την αμέσως ψηλότερη. Πρέπει λοιπόν να βρείτε ποιος κβαντικός αριθμός n αντιστοιχεί στην στάθμη Fermi (είπαμε στο μάθημα πώς). Στην 13, πρέπει να βρείτε το ΔΕ (ενέργεια διέγερσης) σαν συνάρτηση του n, και από αυτό το αντίστοιχο μήκος κύματος λ του φωτονίου (ΔΕ=hf, fλ=c). Μετά θέστε λ=το μέγιστο μήκος κύματος του ορατού φωτός και βρείτε το n. Επαναλάβετε για το ελάχιστο μήκος κύματος του ορατού φωτός.
Άσκηση: αποδείξτε ότι σε κυβικό κρυσταλλικό υλικό, η απόσταση μεταξύ διαδοχικών επιπέδων (hkl) δίνεται από τον τύπο που φαίνεται στο σχετικό άρθρο της wikipedia.
Αποκλίσεις από την ιδανική δομή επιφάνειας:
- Xαλάρωση (relaxation) είναι το πλησίασμα μεταξύ των επιφανειακών ατόμων και των ατόμων του δευτέρου επιπέδου. Καθώς τα επιφανειακά άτομα έχουν λιγότερους γείτονες από τα εσωτερικά άτομα, τα ηλεκτρόνιά τους ανακατανέμονται στους εναπομείναντες δεσμούς. Έτσι πχ στην Au(111) κάθε άτομο Au έχει 9 γείτονες έναντι 12 που έχουν τα άτομα στο εσωτερικό του υλικού. Τα ηλεκτρόνια των 3 σπασμένων δεσμών θα μοιραστούν στους 9 εναπομείναντες δεσμούς και θα τους κάνουν ισχυρότερους, άρα και κοντύτερους.
- Αναδόμηση (reconstruction) είναι η κίνηση των επιφανειακών ατόμων παράλληλα στην επιφάνεια ώστε να σχηματίσουν δεσμούς μεταξύ τους. Παρατηρείται περισότερο σε επιφάνειες με μικρή πλήρωση. Δείτε την σχετική σελίδα του R. M. Nix. Άσκηση: Η επιφάνεια (100) δομής ZnS και διαμαντιού, και η (2χ1) αναδόμησή της.
-
Δομικές ατέλειες (structural defects) είναι οι αποκλίσεις από την επίπεδη περιοδική δομή της ιδανικής επιφάνειας. Υπάρχουν σε όλες τις επιφάνειες. Οι κυριότερες είναι τα σκαλοπάτια (steps), τα πρόσθετα άτομα (adatoms), τα κενά (vacancies) (δείτε το σχήμα).
- Τέλος, όλες οι επιφάνειες περιέχουν προσμίξεις λόγω προσρόφησης (adsorption) μορίων του υλικού που τις περιβάλλει. Το θέμα αυτό θα μας αποσχολήσει στο επόμενο μέρος του μαθήματος. Προς το παρόν, ας σκεφτούμε πόσα μόρια αέρα χτυπάνε μια επιφάνεια 1 m2 σε 1 s. Με διαστατική ανάλυση, μπορούμε να βρούμε ότι η απάντηση είναι ανάλογη του λόγου P/√(mkT), όπου P είναι η πίεση του αερίου, Τ η θερμοκρασία και m η μέση μάζα των μορίων του αέρα. O ακριβής τύπος είναι ο τύπος των Hertz-Knudsen, Z=P/√(2πmkT). Με βάση αυτόν τον τύπο, μπορούμε να δείξουμε ότι σε K.Σ μια επιφάνεια θα καλυφθεί πλήρως σε μερικά ns! Για να έχουμε καθαρές επιφάνειες για μερικές ώρες απαιτούνται πολύ χαμηλές πιέσεις. Η επιστήμη επιφανειών, που απαιτεί καλά ορισμένες και καθαρές επιφάνειες, γεννήθηκε τη δεκαετία του '80, οπότε και κατασκευάστηκαν καλές συσκευές υπερυψηλού κενού (Ultra-High Vacuum, UHV).
Άσκηση: να υπολογιστεί η επιφανειακή τάση της Si(100) με το μοντέλο των σπασμένων δεσμών για (1) την επιφάνεια όπως προκύπτει κόβοντας τον κρύσταλλο και (2) την αναδομημένη επιφάνεια με περιοδικότητα (2x1).
Διαβάστε το κεφ. 19.2 και 23.3 από την "Φυσικοχημεία" του Atkins.Εργασία 6 (παράδοση ως το πρωί της 30/3/15): άσκηση 25 και 26.
Για τις ασκήσεις θα χρειαστεί ο παρακάτω ορισμός: 1 ML (monolayer) είναι η ποσότητα ατόμων (πχ αέρα) που απαιείται για να καλυφθούν πλήρως όλα τα άτομα μιας επιφάνειας, δηλαδή να αντιστοιχεί ακριβώς ένα προσροφημένο μόριο σε κάθε μόριο της επιφάνειας. Παράδειγμα: αν έχουμε ρυθμό κρούσεων ανά επιφανειακό άτομο 0.1 s-1, θα έχουμε 1 κρούση κάθε 10s, επομένως κατά μέσο όρο για να σχηματιστεί 1 ML απαιτούνται 10 s.
Σχήμα των νανοσωματιδίων και επιφανειακές τάσεις
Το σχήμα των νανοσωματιδίων καθορίζεται από δυο κυρίως παράγοντες: την ταχύτητα ανάπτυξης των διαφόρων επιφανειών και την επιφανειακή τους τάση. Θα επικεντρωθούμε σε συστήματα σε θερμοδυναμική ισορροπία, οπότε δεν θα ασχοληθούμε με την κινητική.
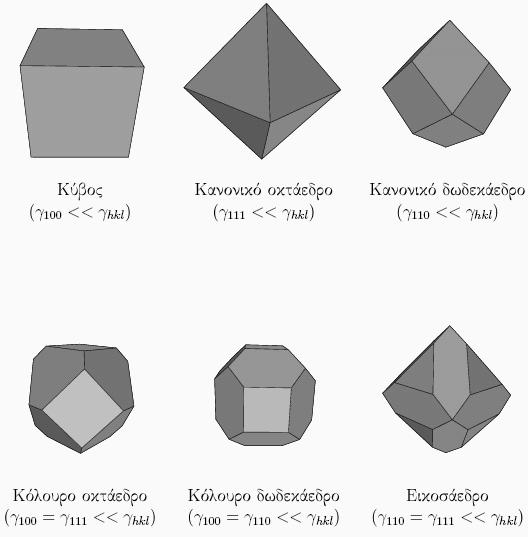 Το νανοσωματίδιο πρέπει να έχει τις ίδιες συμμετρίες που έχει και το αντίστοιχο υλικό. Για παράδειγμα, σε ένα υλικό με κυβική κρυσταλλική δομή (fcc, bcc, sc, diamond, NaCl κτλ) ο κρύσταλλος φαίνεται πανομοιότυπος
αν περιστραφεί κατά 90o γύρω από τρεις άξονες,
οι οποίοι είναι κάθετοι μεταξύ τους. Αυτό σημαίνει ότι επιφάνειες που είναι κάθετες μεταξύ τους έχουν ίδια δομή, και επομένως και ίδια επιφανειακή ενέργεια. Αυτό πχ συμβαίνει με τις (100), (010) και (001) οι οποίες είναι όλες ισοδύναμες σε κρυστάλλους με κυβική συμμετρία. Αντίθετα, αν ο κρύσταλλος έχει εξαγωνική συμμετρία, όπως πχ η δομή hcp, οι έδρες (100) και (001) θα είναι εν γένει πολύ διαφορετικές. Υλικό με κυβική συμμετρία δεν μπορεί να φτιάχνει πυραμιδοειδή νανοσωμάτια, αφού
μια πυραμίδα δεν έχει τρεις κάθετους άξονες συμμετρίας, αλλά μόνο έναν. Αντίθετα, όλα τα παρακάτω σχήματα έχουν τις ίδιες συμμετρίες που έχει και ο κύβος, και άρα θα μπορούσαν να φτιαχτούν νανοσωμάτια τέτοιου σχήματος από κυβικής συμμετρίας υλικά:
Το νανοσωματίδιο πρέπει να έχει τις ίδιες συμμετρίες που έχει και το αντίστοιχο υλικό. Για παράδειγμα, σε ένα υλικό με κυβική κρυσταλλική δομή (fcc, bcc, sc, diamond, NaCl κτλ) ο κρύσταλλος φαίνεται πανομοιότυπος
αν περιστραφεί κατά 90o γύρω από τρεις άξονες,
οι οποίοι είναι κάθετοι μεταξύ τους. Αυτό σημαίνει ότι επιφάνειες που είναι κάθετες μεταξύ τους έχουν ίδια δομή, και επομένως και ίδια επιφανειακή ενέργεια. Αυτό πχ συμβαίνει με τις (100), (010) και (001) οι οποίες είναι όλες ισοδύναμες σε κρυστάλλους με κυβική συμμετρία. Αντίθετα, αν ο κρύσταλλος έχει εξαγωνική συμμετρία, όπως πχ η δομή hcp, οι έδρες (100) και (001) θα είναι εν γένει πολύ διαφορετικές. Υλικό με κυβική συμμετρία δεν μπορεί να φτιάχνει πυραμιδοειδή νανοσωμάτια, αφού
μια πυραμίδα δεν έχει τρεις κάθετους άξονες συμμετρίας, αλλά μόνο έναν. Αντίθετα, όλα τα παρακάτω σχήματα έχουν τις ίδιες συμμετρίες που έχει και ο κύβος, και άρα θα μπορούσαν να φτιαχτούν νανοσωμάτια τέτοιου σχήματος από κυβικής συμμετρίας υλικά:
Το σχήμα του νανοσωματιδίου είναι τέτοιο ώστε να ελαχιστοποιείται η επιφανειακή ενέργεια. Για δεδομένη ποσότητα του υλικού, το σύστημα θα επιλέξει το σχήμα εκείνο το οποίο ελαχιστοποιεί τη συνολική επιφανειακή ενέργεια. Η τελευταία ισούται με το άθροισμα όρων της μορφής γhklAhkl, όπου γhkl είναι η επιφανειακή τάση της επιφάνειας (hkl) και Ahkl το εμβαδόν της επιφάνειας αυτής στο νανοσωμάτιο. Αν μια έδρα έχει αρκετά χαμηλότερη ενέργεια από τις άλλες, τότε αυτή θα καθορίζει το σχήμα.
Παράδειγμα: Στο NaCl, υλικό με κυβική συμμετρία, βρίσκουμε ότι η (100) έχει επιφανειακή τάση ε/α2, όπου ε η ενέργεια ενός ακόρεστου δεσμού και α η πλεγματική σταθερά. Για τις (110) και (111) βρίσκουμε επιφανειακές τάσεις κατά 2√2 και 4√3 μεγαλύτερες, αντίστοιχα. Επομένως, με βάση το παραπάνω σχήμα, περιμένουμε το σχήμα των κρυστάλλων του ορυκτού αλατιού να είναι κυβικό, όπως και είναι.
Παράδειγμα ΙΙ: Στο διαμάντι, επίσης υλικό με κυβική συμμετρία, βρίσκουμε ότι η (100) έχει ενέργεια 4ε/α2, όπου ε η ενέργεια ενός ακόρεστου δεσμού και α η πλεγματική σταθερά. Για την (110) βρίσκουμε 2√2ε/α2 και για την (111) βρίσκουμε (4/√4)ε/α2. Η (111) έχει πολύ χαμηλότερη ενέργεια, άρα με βάση το παραπάνω σχήμα το σχήμα των ακατέργαστων διαμαντιών, αλλά και των νανοσωματιδίων Si κλπ, θα πρέπει να είναι κανονικό οκτάεδρο. Και όντως είναι. Δείτε και εδώ.
Θεώρημα Wulff:
Το σχήμα ελάχιστης επιφανειακής ενέργειας είναι εκέινο για το οποίο dhkl/γhkl=σταθερό. dhkl είναι η απόσταση του επιπέδου hkl από το κέντρο του νανοσωματιδίου, και γhkl η επιφανειακή τάση.
Υπενθυμίζεται ότι (α) η εξίσωση επιπέδου κάθετου στο διάνυσμα (α,β,γ) είναι αx+βy+γz=c, c=σταθερά. (β) η απόσταση του σημείου (κ,λ,μ) από το εν λόγω επίπεδο είναι |ακ+βλ+γμ-c|/√(α2+β2+γ2).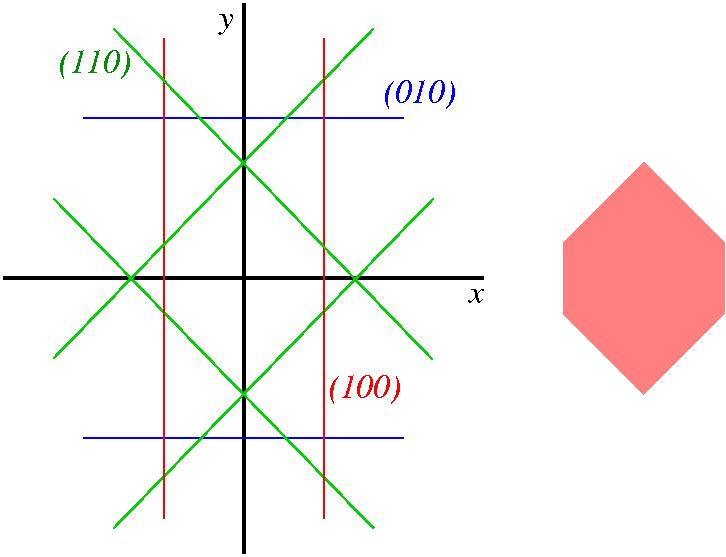 Εφαρμογή: σε κάποιο ορθορομβικό υλικό είναι γ100=γ110=γ, γ010=2γ, γ001=3γ, και γhkl > 3γ για όλα τα άλλα επίπεδα. Βρείτε το σχήμα ελάχιστης ενέργειας.
Εφαρμογή: σε κάποιο ορθορομβικό υλικό είναι γ100=γ110=γ, γ010=2γ, γ001=3γ, και γhkl > 3γ για όλα τα άλλα επίπεδα. Βρείτε το σχήμα ελάχιστης ενέργειας.
- Σχεδιάζω επίπεδο (100) σε απόσταση d από το κέντρο (εξίσωση x=d).
- Από συμμετρία, θα υπάρχει και το -x=d.
- Σχεδιάζω επίπεδο (110) σε απόσταση d (εξίσωση x+y=d√2). Είναι σε ίδια απόσταση με το (100) λόγω θεωρήματος Wulff και αφού γ100=γ110.
- Από συμμετρία, θα υπάρχουν τα επίπεδα -x+y=d√2, x-y=d√2, -x-y=d√2.
- Σχεδιάζω επίπεδο (010) σε απόσταση 2d (εξίσωση y=2d). Είναι σε διπλάσια απόσταση από το (100) λόγω θεωρήματος Wulff και αφού γ010=γ100.
- Από συμμετρία, θα υπάρχει και το -y=2d.
- Με όμοια συλλογιστική βρίσκω ότι τα επίπεδα (001) θα είναι τα z=3d και z=-3d.
- Το σχήμα του νανοσωματιδίου θα περικλείεται από τα επίπεδα που σχεδιάσαμε, και θα είναι ένα πρίσμα με εξαγωνική βάση, η οποία φαίνεται δεξιά. Δεν χρειάζεται να ανησυχούμε για άλλες έδρες, αφού η συνθήκη γhkl > 3γ υπαγορεύει ότι θα απέχουν πάνω από 3d από την αρχή και άρα δεν θα επηρεάζουν το σχήμα.
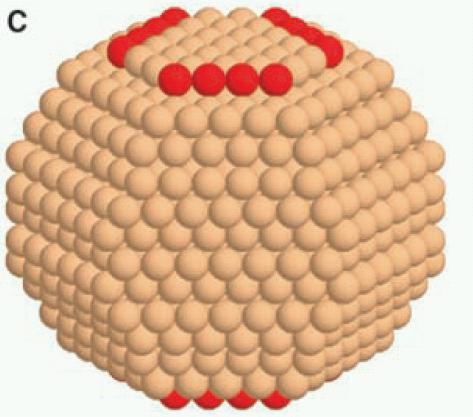 Γενικά, το σχήμα ελάχιστης ενέργειας θα περιέχει πολλών ειδών έδρες. Στην παραπάνω εικόνα φαίνονται σχήματα που περιέχουν μόνο ένα ή μόνο δυο είδη. Σε ένα νανοσωμάτιο Ru, για παράδειγμα,
όπως αυτό του διπλανού σχήματος,εμφανίζονται τουλάχιστον 4 διαφορετικές έδρες (οι 001, 100, 101, 201 -προσέξτε ότι άλλο η 001, άλλο η 100, καθώς το Ru έχει δομή hcp!).
Γενικά, το σχήμα ελάχιστης ενέργειας θα περιέχει πολλών ειδών έδρες. Στην παραπάνω εικόνα φαίνονται σχήματα που περιέχουν μόνο ένα ή μόνο δυο είδη. Σε ένα νανοσωμάτιο Ru, για παράδειγμα,
όπως αυτό του διπλανού σχήματος,εμφανίζονται τουλάχιστον 4 διαφορετικές έδρες (οι 001, 100, 101, 201 -προσέξτε ότι άλλο η 001, άλλο η 100, καθώς το Ru έχει δομή hcp!).
Διεπιφάνειες και διεπιφανειακές τάσεις
Τα νανωσωματίδια σπάνια έχουν κενό γύρω τους. Συνήθως είτε περιέχονται σε κάποιο μέσο (πχ διαλύτης ή κάποιο πολυμερές) ή/και ακουμπούν σε κάποια στερεή επιφάνεια. Έτσι το σωστό είναι να μιλάμε για διεπιφανειακές τάσεις, αντί για επιφανειακές τάσεις που έιχαμε δει ως τώρα. Η επιφανειακή τάση ορίζεται ως το πηλίκο της ενέργειας που απαιτείται για να δημιουργηθεί διεπιφάνεια με εβαδόν Α διά του Α. Για την διεπιφάνεια μεταξύ υλικού με επιφανειακή τάση γ και αερίου ή υγρού, μπορεί να δειχθεί ότι γint=γ-Εads/Αat, όπου Εads η ενέργεια προσρόφησης και Αat το εμβαδόν ανά άτομο στην επιφάνεια.
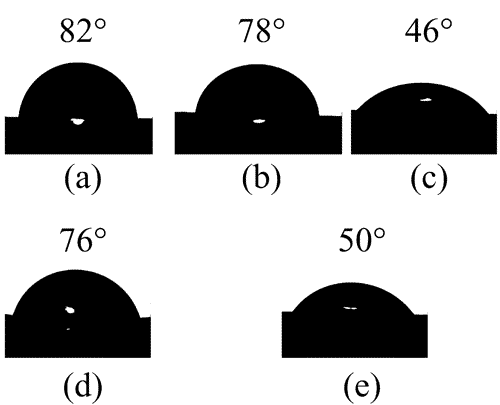 Στην περίπτωση που το υλικό δεν είναι σε ομοιγενές περιβάλλον, αλλά συγκρατείται πάνω σε μια επιφάνεια, το σχήμα του καθορίζεται από
το συνδυασμό των επιφανειακών τάσεων αλλά και της διεπιφανειακής τάσης μεταξύ του υλικού και της επιφανειας. Νανοσωμάτια που συγκρατούνται πάνω σε επιφάνειες θα προσπαθήσουν είτε να έχουν μεγάλο εμβαδόν της διεπιφάνειας, εαν συμβεί η διεπιφάνεια να έχει χαμηλότερη ενέργεια από την επιφάνεια του υποστρώματος. Στην αντίθετη περίπτωση το εμβαδόν της διεπιφάνειας θα είναι μικρό. Η συνάφεια μεταξύ του υλικού και του υποστρώματος αντικατοπτρίζεται στη γωνία επαφής (contact angle), θ. Στην περίπτωση μεγάλης συνάφειας, η γωνία επαφής είναι οξεία, ενώ στην περίπτωση μικρής συνάφειας είναι αμβλεία. Για παράδειγμα, η διπλανή εικόνα δείχνει διάφορες γωνίες επαφής για διεπιφάνεια μεταξύ μιας σταγόνας νερού και διαφόρων πολυμερικών υποστρωμάτων.
Στην περίπτωση που το υλικό δεν είναι σε ομοιγενές περιβάλλον, αλλά συγκρατείται πάνω σε μια επιφάνεια, το σχήμα του καθορίζεται από
το συνδυασμό των επιφανειακών τάσεων αλλά και της διεπιφανειακής τάσης μεταξύ του υλικού και της επιφανειας. Νανοσωμάτια που συγκρατούνται πάνω σε επιφάνειες θα προσπαθήσουν είτε να έχουν μεγάλο εμβαδόν της διεπιφάνειας, εαν συμβεί η διεπιφάνεια να έχει χαμηλότερη ενέργεια από την επιφάνεια του υποστρώματος. Στην αντίθετη περίπτωση το εμβαδόν της διεπιφάνειας θα είναι μικρό. Η συνάφεια μεταξύ του υλικού και του υποστρώματος αντικατοπτρίζεται στη γωνία επαφής (contact angle), θ. Στην περίπτωση μεγάλης συνάφειας, η γωνία επαφής είναι οξεία, ενώ στην περίπτωση μικρής συνάφειας είναι αμβλεία. Για παράδειγμα, η διπλανή εικόνα δείχνει διάφορες γωνίες επαφής για διεπιφάνεια μεταξύ μιας σταγόνας νερού και διαφόρων πολυμερικών υποστρωμάτων.
Η σχέση γωνίας επαφής και διεπιφανειακής τάσης δίνεται από τον τύπο του Young:
γ2=γint+γ1cosθ,
όπου γ2 είναι η επιφανειακή τάση του υποστρώματος, γ1 η επιφανειακή τάση του υλικού ή του νανοσωματιδίου, γint η διεπιφανειακή τάση και θ η γωνία επαφής. Οι επιφάνειες των υγρών ασκούν δύναμη παράλληλη προς αυτές με μέτρο F=γL, όπου γ είναι η επιφανειακή τάση και L το μήκος της επιφάνειας κάθετα στην κατεύθυνση του F. Η επιφανειακή τάση εκφράζει την απροθυμία των υγρών να αυξήσουν το εμβαδόν της επιφάνειάς τους.
'Ασκηση: Βρείτε τι σχήμα θα πάρει μια σταγόνα βενζίνης πάνω σε επιφάνεια νερού. Η επιφανειακή τάση της βενζίνης και του νερού είναι 0.029 J/m2 και 0.073 J/m2, αντίστοιχα, και η διεπιφανειακή τους τάση είναι 0.035 J/m2. Καθώς η βενζίνη ανακατεύεται με το νερό, η επιφανειακή τάση του νερού μειώνεται στα 0.062 J/m2. Επαναλάβετε τον υπολογισμό. Παρατηρείστε ότι (α) οι επιφανειακές τάσεις των υγρών είναι 10 με 100 φορές μικρότερες από αυτές των στερεών και (β) όταν η διεπιφανειακή τάση γίνει πολύ μικρότερη από την επιφανειακή τάση του υποστρώματος, ο τύπος του Young δίνει cosθ>1. Αυτό σημαίνει ότι το υγρό απλώνεται σε όσο γίνεται μεγαλύτερη έκταση, φτιάχνοντας τεράστιες σταγόνες πάχους ενός μορίου. Αυτές λέγονται υμένια Langmuir–Blodgett.Διάβασμα: Atkins 17.8, 19.9 (πρώτη παράγραφος) και το μισό περίπου άρθρο για το θεώρημα Wulff.
Εργασία 7 (παράδοση ως το πρωί της 20/4/15): άσκηση 42 και 46.
Κινητική της προσρόφησης και εκρόφησης
Οι διαδικασίες προσρόφησης και εκρόφησης (όπως και κάθε χημική αντίδραση) χαρακτηρίζονται από μια ενέργεια ενεργοποίησης (activation energy) δηλαδή το ενεργειακό φράγμα που απαιτείται να υπερπηδηθεί για να γίνει η αντίδραση, και μια θερμότητα (ακριβέστερα, ενέργεια Gibbs) αντίδρασης, η οποία αντιστοιχεί στην διαφορά ενέργειας μεταξύ αντιδρώντων και προϊόντων. Η ενέργεια ενεργοποίησης καθορίζει την ταχύτητα της αντίδρασης (k=k0exp(-Ea/RT) με k0~kBT/h) ενώ η θερμότητα αντίδρασης καθορίζει τη σταθερά της χημικής ισορροπίας (K=K0exp(-ΔH/RT)).
To ποσοστό επικάλυψης, θ, ορίζεται ως ο λόγος του αριθμού των προσροφημένων μορίων δια τον αριθμό των διαθέσιμων θέσεων. Θέσεις προσρόφησης είναι πάνω από άτομο της επιφάνειας (on top), μεταξύ δυο επιφανειακών ατόμων (bridge) ή ανάμεσα σε περισότερα επιφανειακά άτομα (hollow). Συνήθως αντιστοιχεί μια διαθέσιμη θέση προσρόφησης ανά επιφανειακό άτομο. Μόρια με ισχυρά κατευθυντικά τροχιακά επιλέγουν συνήθως θέσεις on top (όπως πχ το CO στην Pt(111)), ενώ μόρια με τροχιακά τύπου s επιλέγουν θέσεις με πολλούς γείτονες (πχ Η2 στην Al(100)).
Όπως ξέρουμε από τη θερμοδυναμική, κάθε σύστημα προσαρμόζει την κατάστασή του ώστε να ελαχιστοποιεί την ελεύθερη ενέργειά του, G=U+PV-TS U είναι η ενέργεια και S η εντροπία. Δικαιολογήστε το γεγονός ότι στην αέρια φάση τα μόρια έχουν ψηλότερη ενέργεια αλλά και ψηλότερη εντροπία σε σχέση με τα προσροφημένα μόρια. Σε ψηλές θερμοκρασίες, ο όρος TS είναι πιο σημαντικός από την U και έτσι η ελάχιστη τιμή της G επιτυγχάνεται όταν μεγιστοποιείται η εντροπία, S. Οπότε το σύστημα προτιμάει την αέρια φάση από την προσροφημένη. Αντίθετα, σε χαμηλες θερμοκρασίες το TS θα είναι πολύ μικρό οπότε η ελαχιστοποίηση της G επιτυχγάνεται όταν ελαχιστοποιείται η U. Οπότε το σύστημα προτιμάει την προσροφημένη φάση. Η πίεση επιδρά στο σύστημα μέσω κυρίως της εντροπίας του αερίου: καθώς αυξάνεται η πίεση, μικραίνει η εντροπία. Επομένως αύξηση της πίεσης ευνοεί την προσρόφηση. Συνοψίζοντας, η προσρόφηση ευνοείται όταν η θερμοκρασία είναι χαμηλή και η πίεση είναι υψηλή.
Η ισόθερμη Langmuir: πώς εξαρτάται το ποσοστό επικάλυψης από την πίεση του αερίου. Εφαρμογή: υπολογισμός της ποσότητας αερίου που απαιτείται για να καλυφθεί πλήρως μια επιφάνεια απο μετρήσεις πίεσης/όγκου προσροφημένης ουσίας
Η σταθερά K της χημικής ισορροπίας συνδέεται με την ενέργεια προσρόφησης μέσω της K=K0exp(-ΔΕ/kBT). ΔΕ είναι η διαφορά στην ενέργεια μεταξύ αέριας και προσροφημένης φάσης (συνήθως αρνητική). Αυτή η σχέση μας επιτρέπει τον προσδιορισμό της ενθαλπίας προσρόφησης μέσω πειράματος όπου μεταβάλλουμε την πίεση και τη θερμοκρασία έτσι ώστε η επιφανειακή συγκέντρωση να μένει σταθερή.
Άσκηση: Κομμάτι γραφίτη βρίσκεται σε ισορροπία με αέριο CO υπό υπο πίεση P και θερμοκρασία Τ. Μεταβάλλουμε την πίεση και για κάθε πίεση βρίσκουμε την θερμοκρασία ώστε να προσροφάται σε κάθε πείραμα ακριβώς ίδια ποσότητα CO. Με τέτοιες μετρήσεις, παίρνουμε τον παρακάτω πίνακα τιμών. Υπολογίστε την ενέργεια προσρόφησης του CO στον γραφίτη. Πρόκειται για φυσιρόφηση ή χημιρόφηση; (παράδειγμα 23.5 Atkins)
| P (Torr) | Τ (Κ) |
| 30.0 | 200 |
| 45.2 | 220 |
| 73.9 | 250 |
Εργασία 8 (παράδοση ως το πρωί της 27/4/15): άσκηση 52 και 61.
Εφαρμογές της θεωρίας του Langmuir: (α) εκτίμηση του μέσου χρόνου παραμονής σε επιφάνεια, (β) εύρεση του είδους της προσρόφησης μορίων (μοριακά ή με διάσπαση), (γ) υπολογισμός εμβαδού επιφανειών και (δ) προσρόφηση σε πολλά στρώματα (θεωρία BET).
Ο μέσος χρόνος παραμονής ενός μορίου σε μια επιφάνεια εξαρτάται από την ενέργεια που απαιτείται για να εκροφηθεί το μόριο. Ονομάζουμε χημειορρόφηση την περίπτωση όπου ο χρόνος αυτός είναι μεγάλος (οπότε σχηματίζεται χημικός δεσμός μεταξύ του μορίου και της επιφάνειας) και φυσιρρόφηση την περίπτωση όπου ο χρόνος είναι αμελήτέος (οπότε το μόριο απλά ακουμπάει στην επιφάνεια). Έχουμε χημιρρόφηση όταν είναι ποερίπου Ed > 50 kJ/mol. Ο χρόνος χαρακτηρίζεται μεγάλος ή μικρός σε σύγκριση με τον μέσο χρόνο μεταξύ κρούσεων μορίων στην επιφάνεια, ο οποίος σε ΚΣ είναι της τάξης των 10 ns, όπως προκύπτει από τον τύπο Hertz-Knudsen που είδαμε νωρίτερα στο μάθημα.
Άσκηση: Κομμάτι σιδήρου βρίσκεται σε ισορροπία με αέριο οξυγόνο υπο πίεση P. Μεταβάλλουμε την πίεση και ζυγίζουμε το μέταλλο. Με τέτοιες μετρήσεις, παίρνουμε τον παρακάτω πίνακα τιμών για την πίεση του οξυγόνου και την μάζα που προσροφήθηκε κάθε φορά:
| P (Pa) | m (μgr) |
| 0.28 | 1.40 |
| 0.61 | 2.21 |
| 0.95 | 2.78 |
| 1.70 | 3.23 |
(α) Βρείτε αν στην επιφάνεια του σιδήρου έχουμε μοριακό ή ατομικό οξυγόνο. Για να απαντήσετε, εξετάστε αν ισχύει η εξίσωση θ=KP/(1+KP) (προσρόφηση χωρίς διάσπαση) ή η εξίσωση θ=√(K'P)/(1+√(Κ'P)) (προσρόφηση με διάσπαση). Χρησιμοποιήστε τη σχέση θ=m/m∞. Είναι καλύτερα να δουλέψουμε με σχέσεις της μορφής y=ax+b. Αν είχα μοριακό οξυγόνο, η πρώτη σχέση δίνει (P/m)=(1/m∞K)+(1/m∞)P , δηλαδή y=P/m, x=P. Αντίθετα, αν είχα ατομικό οξυγόνο, η δεύτερη σχέση δίνει (√P/m)=(1/m∞K')+(1/m∞)√P , δηλαδή y=√P/m, x=√P. Φτιάξτε τις δυο γραφικές παραστάσεις. Ποια από τις δυο μοιάζει περισότερο με ευθεία; Τι συμπεραίνετε για το είδος του προσροφημένου οξυγόνου;
(β) Από την σωστή γραφική παράσταση, αυτή δηλαδή που μοιάζει με ευθεία, υπολογίστε την παράμετρο m∞. Εξηγήστε πώς μπορύμε από την παράμετρο αυτή να υπολογίσουμε το εμβαδόν της επιφάνειας, γνωρίζοντας την απόσταση μεταξύ γειτονικών ατόμων.
Η ισόθερμη ΒΕΤ περιγράφει περιπτώσεις όπου μόρια μπορούν να προσροφώνται πάνω σε ήδη προσροφημένα μόρια. Η ισόθερμη ανάγεται στον τύπο του Langmuir σε πολύ χαμηλές πιέσεις.
Η ύλη του μαθήματος περιγράφεται πλήρως στα κεφ. 23.4 και 23.5 του βιβλίου του Atkins.Εργασία 9 (παράδοση ως το πρωί της 4/5/15): άσκηση 67 και 70.
Υπόδειξη για την εργασία 8: oι ρυθμοί προσρόφησης και εκρόφησης δίνονται από τις σχέσεις r=AatP/√(2πmkT) και r=k0 exp(-Ed/RT). Ο μέσος χρόνος είναι προφανώς τ=1/r.
Κατάλυση
Λέγοντας κατάλυση, εννοούμε την επιτάχυνση χημικών αντιδράσεων χρησιμοποιώντας μια ουσία (η οποία λέγεται καταλύτης), η οποία δεν μεταβάλλεται κατά τη διάρκεια της αντίδρασης. Η κατάλυση μπορεί να είναι ομογενής, αν ο καταλύτης βρίσκεται στην ίδια φάση με τα αντιδρώντα (πχ τα ένζυμα που μετατρέπουν το μούστο σε κρασί) ή ετερογενής, αν ο καταλύτης δεν ρίσκεται στην ίδια φάση με τα αντιδρώντα (πχ νανοσωματίδια Rh που οξειδώνουν αέριο CO σε CO2 στα αυτοκίνητα). Ο καταλύτης δεν μπορεί να αλλάξει τη θερμότητα της αντίδρασης, και να κάνει πχ μια ενδόθερμη αντίδραση να γίνει εξώθερμη. Μπορεί όμως να αλλάξει τη σταθερά της χημικής ισορροπίας, και άρα την απόδοση της αντίδρασης. Η πιο σημαντική όμως ιδιότητα του καταλύτη είναι ότι αυξάνει, σηνήθως κατά πολλές τάξεις μεγέθους, την ταχύτητα της αντίδρασης, καθώς μειώνει την ενέργεια ενεργοποίησης. Για να πειστείτε, υπολογίστε το λόγο των exp(-E/RT) και exp(-E'/RT) όταν T=300 K και Ε'-Ε=1 eV ~ 100 kJ/mol.
Οι δυο βασικές αρχές της κατάλυσης είναι η αρχή του Langmuir, σύμφωνα με την οποία είναι πολύ πιθανότερο να αντιδράσουν δυο μόρια σε δυο παρά σε τρεις διαστάσεις, και η αρχή του Sabatier, σύμφωνα με την οποία οι καλύτεροι καταλύτες είναι αυτοί που έχουν μέτρια ενέργεια προσρόφησης για τα μόρια των αντιδρώντων (ούτε χαμηλή, οπότε θ~0, αλλά ούτε και υψηλή, οπότε θ*~0).
Ο πιο απλός μηχανισμός κατάλυσης, με εφαρμογή τόσο σε ομοιογενή όσο και σε ετερογενή κατάλυση είναι ο μηχανισμός Michaelis-Menten.
Για την αντίδραση A+B↔P υπάρχουν δυο μηχανισμοί: (α) ο Eley-Rideal:
| A+* ↔ A* | (1) |
| B+ A* ↔ P + * | (2) |
και (β) ο Langmuir-Hinshelwood:
| A+* ↔ A* | (1) |
| B+* ↔ B* | (2) |
| B*+ A* ↔ P + 2* | (3) |
Ο μηχανισμός Langmuir είναι ο πιο συνηθισμένος.
Άσκηση: πως εξαρτάται ο ρυθμός παραγωγής P στον μηχανισμό Eley-Rideal από την συγκέντρωση του Α;
Λύση: Ας φανταστούμε την αντίδραση CO+O↔CO2 στον μηχανισμό Eley-Rideal:
| CO+* ↔ CO* | (1) |
| O+ CO* ↔ CO2 + * | (2) |
Προφανώς η (2) θα έχει πολύ μεγαλύτερη ενέργεια ενεργοποίησης από την (1), αφού πρέπει να σπάσει ο δεσμός άνθρακα-μετάλλου. Οπότε θα θεωρήσω ότι ο ρυθμός της συνολικής αντίδρασης ισούται με το ρυθμό της (2). Αυτή είναι η προσέγγιση του rate-determining step (RDS). Επομένως r=kPΒθΑ-k'PPθ*=kPΒθΑ αφού και η συγκέντρωση του P θα είναι πολύ μικρότερη από την συγκέντρωση του Α αλλά και το θ* είναι πολύ μικρότερο του θB. Από την (1) την οποία θεωρώ σε ισοροπία έχω ότι θΑ=ΚPΑ/(1+ΚPΑ), άρα τελικά (λαμβάνοντας υπ'όψιν ότι PΑ+PB=P) είναι r=kPA(P-PΑ)/(1+ΚPΑ). Παρατηρήστε ότι ο ρυθμός μηδενίζεται αν η συγκέντρωση του Α είναι 0 ή 1, και έχει μέγιστο σε μια ενδιάμεση τιμή. Αυτό ισχύει στις περισσότερες καταλυτικές αντιδράσεις: ο ρυθμός μεγιστοποιείται για μια ενδιάμεση τιμή της συγκέντρωσης, της πίεσης και της θερμοκρασίας.
Οι παρακάτω εικόνες δίνουν γραφικές παραστάσεις του παραπάνω ρυθμού για k0=1013, K0=10-3, ΔΕ=-0.5 eV και Εa=0.3 eV. Ο ρυθμός, r, μετριέται σε μόρια P που παράγονται σε ένα s. Παρατηρήστε ότι η συγκεκριμένη καταλυτική αντίδραση γίνεται με τον μεγαλύτερο ρυθμό όταν η συγκέντρωση του Α είναι κοντά στο 50% και η θερμοκρασία γύρω στους 850 Κ.
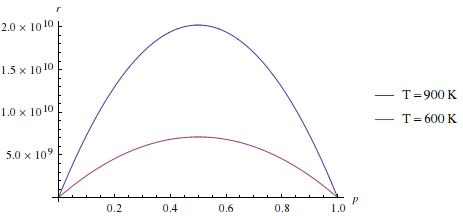
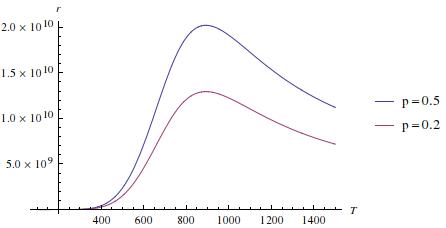
Η ύλη του σημερινού μαθήματος περιγράφεται στα κεφ. 23.2(α), 23.6 και 23.7(σελ. 999) του βιβλίου του Atkins.
Εργασία 10 (παράδοση ως το πρωί της 11/5/15): άσκηση 72 και 74.
Οξείδωση του CO
Για να δούμε πως εξαρτάται η ταχύτητα καταλυόμενης αντίδρασης από τη θερμοκρασία, ας δούμε ένα ρεαλιστικό παράδειγμα, συγκεκριμένα την οξείδωση του CO σε επιφάνεια Rh. Παρόμοια ανιδραση γίνεται σε καταλύτες αυτοκινήτου. Στα παρακάτω το σύμβολο PX δηλώνει το λόγο της μερικής πίεσης του Χ προς τη συνολική πίεση, δηλαδή το κλάσμα του Χ στο αέριο.
| CO+*↔CO* | θCO=ΚCOpCOθ* | (1) |
| 1/2O2+*↔O* | θO=√(ΚOpO2)θ* | (2) |
| CO*+O*↔CO2*+* | r=k θCOθO-k'θCO2θ* | (3) |
| CO2*↔CO2+* | θCO2=ΚCO2 pCO2 θ* | (4) |
| Ποσοστά επικάλυψης: | θCO+θCO2+θO+θ*=1 | (5) |
| Νόμος Dalton: | pCO+pO+pCO2=1 | (6) |
Θεωρούμε ότι ένα βήμα (εδώ το (3)) είναι το πιο αργό από όλα, και επομένως αυτό καθορίζει το ρυθμό της συνολικής αντίδρασης (Rate-Limiting Step, RLS). Για την αντίδραση αυτή θα θεωρήουμε ότι πάει μόνο προς τα δεξιά (δηλαδή ότι k'=0), ενώ οι άλλες αντιδράσεις είναι σε ισορροπία. Λύνοντας τις παραπάνω εξισώσεις, μπορούμε να βρούμε τα θ και το ρυθμό της αντίδρασης, r, για τυχούσες τιμές της θερμοκρασίας και της περιεκτικότητας του αερίου σε CO.
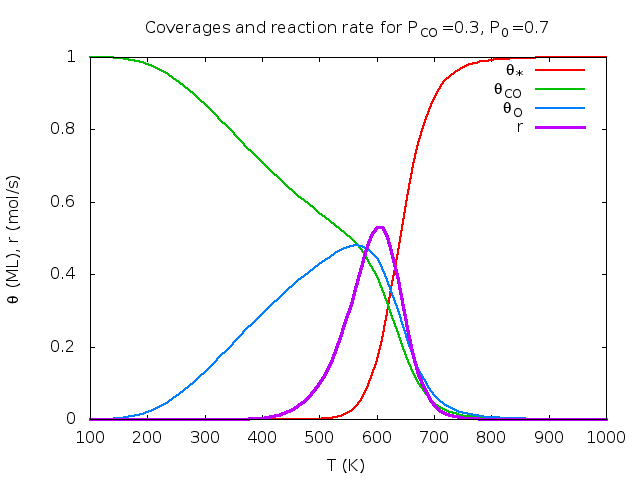
Άσκηση (από το βιβλίο του Chorkendorff) : Στην επιφάνεια Rh(111) έγιναν οι παρακάτω μετρήσεις για την οξείδωση του CO: k=1 mol/sec στους 540K και Ea=50 kJ/mol. KCO=1 στους 650 K και ΔΗCO=-135 kJ/mol. KO=1 στους 630 K και ΔΗO=-250 kJ/mol. ΚCO2 αμελητέο. Υπολογίστε τα ποσοστά επικάλυψης και το ρυθμό παραγωγής CO2 για Τ=600 Κ και αέριο που περιέχει 30% CO και 70% Ο2.
Λύση: θ*=0.17, θCO=0.39, θO=0.44, θCO2=0.00, r=0.53 mol/sec. Παρακάτω δίνονται γραφικές παραστάσεις των ποσοτήτων αυτών σαν συνάρτηση της θερμοκρασίας και του κλάσματος CO. Οι καμπύλες φτιάχτηκαν στο πρόγραμμα Gnuplot με αυτό το προγραμματάκι. Τα πειραματικά δεδομένα πάρθηκαν από το βιβλίο των Chorkendorff-Niemantsverdriet (βλέπε τη βιβλιογραφία του μαθήματος).
| Μεταβλητή θερμοκρασία, κλάσμα CO στο αέριο pCO=0.3. | Μεταβλητό κλάσμα CO στο αέριο, T=600K. | Ρυθμός συναρτήσει Τ, pCO. |
 |
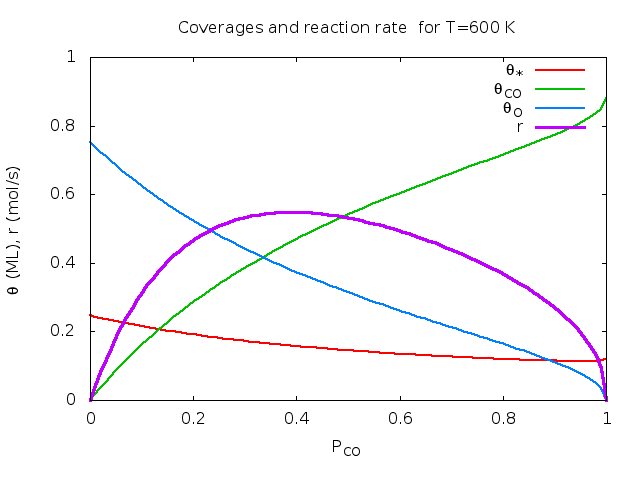 |
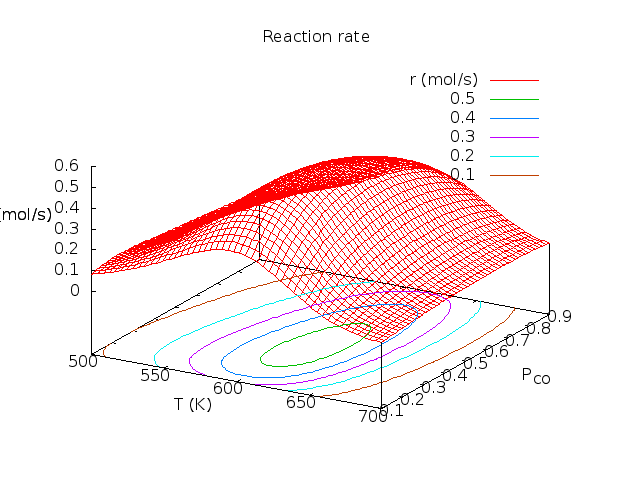 |
Για κάθε καταλύτη και για κάθε αντίδραση υπάρχει συγκεκριμένη περιοχή τιμών πίεσης και θερμοκρασίας στην οποία η απόδοση είναι βέλτιστη. Για αυτό αυτές οι γραφικές παραστάσεις ονομάζονται καμπύλες ηφαιστείου (volcano curves).
Κατάλυση και νανοσωματίδια: ενεργές θέσεις
Εκτός από τις θέσεις προσρόφησης που μελετήσαμε (bridge, ontop, hollow), και οι οποίες αφορούν προσρόφηση σε επίπεδη επιφάνεια (terrace), υπάρχουν και θέσεις προσρόφησης σε ατέλειες της επιφάνειας. Η πιο συχνή ατέλεια είναι ένα σκαλοπάτι (step) στο οποίο μπορεί να έχουμε προσρόφηση σε θέση step, ontop ή step, bridge. Επίσης η γωνία όπου συναντώνται δυο μη παράλληλα σκαλοπάτια (kink) είναι μια πιθανή θέση προσρόφησης. Ένα άτομο σε σκαλοπάτι έχει περισότερους σπασμένους δεσμούς από ένα άτομο σε επίπεδη επιφάνεια, κι ένα άτομο σε kink έχει ακόμα περισσότερους. Άρα για την προσρόφηση ενός τυχόντος μορίου στην επιφάνεια περιμένουμε να ισχύει
Η ποιότητα ενός καταλύτη μετριέται από τον ρυθμό μετατροπής (turnover frequency):
Παράδειγμα 1: Κάποιος (μη ρεαλιστικός) καταλύτης αποτελείται από σφαιρικά σωματίδια ακτίνας R. Όλα τα άτομα της επιφάνειας είναι ενεργά. Υπολογίστε το nact. Απάντηση: nact=(σταθ.)/R. Συμφέρει επομένως να έχουμε όσο γίνεται μικρότερα σωματίδια.
 Παράδειγμα 2: Κάποιος (ρεαλιστικός) καταλύτης αποτελείται από κυβικά νανοσωματίδια μετάλλου ακμής d σε ποσοστό χ κατά βάρος, και αδρανές κεραμικό υπόστρωμα. Μόνο οι θέσεις step ontop είναι ενεργές. Υπολογίστε το nact. Απάντηση: nact=0 για d ≤ 2D και nact=12χ(d/D-2)/(AB)/(d/D)3, για d ≥ 3D. όπου D η ακτίνα του ατόμου του μετάλλου, και (ΑΒ) το ατομικό του βάρος. To n είναι 0 σε πολύ μικρά νανοσωματίδια, έχει ένα μέγιστο της τάξης των 100 μmol/gr και μετά πέφτει απότομα σε μεγάλα νανοσωματίδια. Η εικόνα είναι πολύ παρόμοια με ένα ρεαλιστικό υπολογισμό του nact για νανοσωμάτια Ru σε έναν καταλύτη σύνθεσης αμμωνίας, όπως φαίνεται στην διπλανή εικόνα. Για περισότερες πληροφορίες, δείτε το άρθρο
Παράδειγμα 2: Κάποιος (ρεαλιστικός) καταλύτης αποτελείται από κυβικά νανοσωματίδια μετάλλου ακμής d σε ποσοστό χ κατά βάρος, και αδρανές κεραμικό υπόστρωμα. Μόνο οι θέσεις step ontop είναι ενεργές. Υπολογίστε το nact. Απάντηση: nact=0 για d ≤ 2D και nact=12χ(d/D-2)/(AB)/(d/D)3, για d ≥ 3D. όπου D η ακτίνα του ατόμου του μετάλλου, και (ΑΒ) το ατομικό του βάρος. To n είναι 0 σε πολύ μικρά νανοσωματίδια, έχει ένα μέγιστο της τάξης των 100 μmol/gr και μετά πέφτει απότομα σε μεγάλα νανοσωματίδια. Η εικόνα είναι πολύ παρόμοια με ένα ρεαλιστικό υπολογισμό του nact για νανοσωμάτια Ru σε έναν καταλύτη σύνθεσης αμμωνίας, όπως φαίνεται στην διπλανή εικόνα. Για περισότερες πληροφορίες, δείτε το άρθρο
Εργασία 11 (παράδοση ως το πρωί της 18/5/15): άσκηση 48 και 86.
Ανακοινώσεις
- H τελική προθεσμία παράδοσης παλιών ασκήσεων είναι στις 21/5. Ασκήσεις που θα παραδοθούν αργότερα δεν θα μετρήσουν στον βαθμό.
- Tο μάθημα της 14/5 δεν θα γίνει, και θα αναπληρωθεί την Δευτέρα 18/5 και ώρα 12-2 στην αίθοθυσα Α210 του μαθηματικού.
- Υπενθυμίζεται η προθεσμία υποβολής περιλήψεων για τις παρουσιάσεις την Δευτέρα 11/5.
Παρουσιάσεις
Σήμερα έγιναν οι παρουσιάσεις του μαθήματος, οι οποίες θεωρώ ότι ήταν αρκετά καλές. Δείτε την βαθμολογία, η οποία περιλαμβάνει και τις ασκήσεις για το σπίτι. Η στήλη "ΠΑΡ. – ΚΟΙΝΟ" είναι ο μέσος όρος των βαθμών που έβαλαν οι συμφοιτητές σας στην διάρκεια της παρουσίασης. Η στήλη "ΠΑΡ. – ΙΡ" είναι οι δικοί μου βαθμοί. Η βαθμολογία του κοινού είχε πολύ μικρό εύρος (από 8.2 έως 9.3) και για αυτό την κανονικοποίησα στην στήλη "ΠΑΡ. - ΚΟΙΝΟ ΔΙΟΡΘ." ώστε να έχει ίδιο εύρος με τους δικούς μου βαθμούς (από 4 έως 10). Σε 8 από τις 15 παρουσιάσεις είχαμε πρακτικά ίδιο βαθμό, σε 4 το κοινό ήταν πιο αυστηρό ενώ σε 3 το κοινό ήταν πιο επιεικές. Σε αυτές τις περιπτώσεις άλλαξα τον βαθμό μου λαμβάνοντας υπ'όψιν την παρουσία στην τάξη, την περίληψη της παρουσίασης και την ποιότητα της ερώτησης που έκανε το άτομο αυτό. Ο βαθμός της παρουσίασης είναι το "ΠΑΡ" και με βάση αυτό βγήκε ο τελικός βαθμός "ΣΥΝ" και η στογγυλοποίησή του "Β".
Αν κάποιος θέλει να βελτιώσει τον βαθμό του, μπορεί να έρθει και στην τελική εξέταση.
Ανακοίνωση: δόθηκε παράταση για την παράδοση παλαιών ασκήσεων ως την Δευτέρα 25/5 και ώρα 10 το πρωί. Όσες ασκήσεις παραδοθούν ως τότε θα βαθμολογηθούν με -2 μονάδες (δηλ. με 2, 5 ή 8) σύμφωνα με τον κανονισμό του μαθήματος. Ο τελικός πίνακας βαθμολογίας θα αναρτηθεί εδώ μετά την γραπτή εξέταση.

