Η έννοια της νανοτεχνολογίας
Από την ομιλία του Richard Feynmann, "There's Plenty of Room at the Bottom", το 1959:- Εκτιμήστε πόση σμύκρινση απαιτείται για να γραψουμε μια εγκυκλοπαίδεια στο κεφάλι μιας καρφίτσας. Σε αυτή τη σμίκρυνση, βρείτε πόσα άτομα θα χρειαστούν για να απεικονιστεί η μικρότερη κουκίδα πλάτους 0.2 mm.
- Υποθέστε τώρα ότι, αντί να χρησιμοποιήσουμε αυτά τα άτομα για να απεικονίσουμε μια κουκίδα, τα χρησημοποιούμε για να εγγράψουμε 1 bit πληροφορίας. Βρείτε πόσα άτομα απαιτούνται για να εγγράψουμε το κείμενο από όλα τα βιβλία του κόσμου. Δείξτε ότι χρειάζεται υλικό όσο περίπου ένας κόκος σκόνης. Υποθέστε ότι υπάρχουν περίπου 107 βιβλία. Πώς θα μπορούσαμε να εκτιμήσουμε τον αριθμό αυτό;
- Γιατί η σημερινή τεχνολογία, παρότι έχει προ πολλού ξεπεράσει το επίπεδο (1), απέχει πάρα πολύ από το επίπεδο (2);
Οι βασικές φυσικές ιδιότητες που χαρακτηρίζουν τα νανοϋλικά
- Πολλά άτομα σε επιφάνειες σε σχέση με τα εσωτερικά άτομα.
- Κβαντισμένες στάθμες, με χάσματα συγκρίσιμα με τις ενέργειες οπτικών φωτονίων.
- Η ενέργεια που απαιτείται για να προστεθεί ή να αφαιρεθεί ένα ηλεκτρόνιο είναι πολύ μεγαλύτερη της θερμικής ενέργειας kT.
Για να καταλάβετε τη θεμελιώση σχέση μεταξύ επιφανειών και νανοϋλικών, υπολογίστε το λόγο του αριθμού των εσωτερικών ατόμων προς τον αριθμό των ατόμων της επιφάνειας σε μια απλή κυβική διάταξη ατόμων, όταν η ακμή του κύβου είναι (α) 1 cm και (β) 1 nm.
Θεωρήστε ένα καλώδιο μήκους L, και ένα ηλεκτρόνιο που κινείται ελεύθερα κατα μήκος του, αλλά δεν μπορεί να κινηθεί εκτός του καλωδίου. Λύστε την εξίσωση Schrodinger στο σύστημα και προσδιορίστε τις ιδιοενέργειες του ηλεκτρονίου. Δείτε πχ στο βιβλίο του Σ. Τραχανά, Κβαντομηχανική Ι, Ηράκλειο 2005, κεφ. 5, σελ. 217.
Θεωρήστε τώρα ότι έχουμε Ν ηλεκτρόνια στο καλωδιο. Ο αριθμός Ν μπορεί να εκτιμηθεί θεωρώντας ότι στην ύλη σε κάθε άτομο (διαμέτρου 0.2-0.3 nm) αντιστοιχούν 1-3 ηλεκτρόνια σθένους, άρα N/L είναι περίπου 10 nm-1 Εκτιμήστε τις ενέργεις που σχετίζονται με πρόσθεση ή αφαίρεση ενός ηλεκτρονίου από το σύστημα, όταν το μήκος του καλωδίου είναι 1 nm ή 1 μm ή 1 cm. Παρατηρήστε ότι μόνο στην περίπτωση των νανοϋλικών έχω μετρήσιμες ενέργειες, οι οποίες μάλιστα είναι κοντά στις ενέργειες οπτικών φωτονίων. Δηλαδή τα νανοϋλικά απορροφούν ενέργεια στο ορατό. Εφαρμογές;
Δείξτε ότι οι ενέργειες που βρήκατε είναι πολύ μεγαλύτερες από τη θερμική ενέργεια (kT). Τι σημαίνει αυτό; Το φαινόμενο αυτό λέγεται κβαντική φραγή Coulomb. Μελετήστε το κλασσικό ανάλογο, που είναι η φόρτιση μεταλλικού σώματος με το ελάχιστο φορτίο, e. Πάρτε για απλότητα μια σφαίρα ακτίνας R. Δείξτε ότι η ενέργεια φόρτισης γίνεται πολύ μεγαλύτερη του kT όταν το R πέσει στην περιοχή του nm.
Προσρόφηση αερίων σε επιφάνειες στερεών
Όπως ξέρουμε από τη θερμοδυναμική, κάθε σύστημα προσαρμόζει την κατάστασή του ώστε να ελαχιστοποιεί την ελεύθερη ενέργειά του, F=U-TS (υπό σταθερή πίεση. Αν υπάρχει και πίεση ελαχιστοποιείται το G=F+PV). U είναι η ενέργεια και S η εντροπία. Εφαρμόστε τον κανόνα αυτόν για να προβλέψετε αν τα περισσότερα μόρια από την αέρια φάση θα προσροφηθούν σε μια επιφάνεια στερεού με την οποία βρίσκονται σε ισοροπία ή θα προτιμήσουν να παραμείνουν στην αέρια φάση. Δικαιολογήστε το γεγονός ότι στην αέρια φάση τα μόρια έχουν ψηλότερη ενέργεια αλλά και ψηλότερη εντροπία σε σχέση με τα προσροφημένα μόρια. Τι περιμένετε να συμβεί σε πολύ χαμηλές και τι σε πολύ ψηλές θερμοκρασίες;
Η ισόθερμη του Langmuir: Βρείτε πως εξαρτάται η επιφανειακή συγκέντρωση από την πίεση (σε σταθερή Τ), θεωρώντας ισορροπία μεταξύ μορίων στην αέρια φάση και παροσροφημέων μορίων. (Attard and Barnes κεφ. 1.1 and 1.2.)
Εφαρμογή: Κομμάτι σιδήρου βρίσκεται σε ισορροπία με αέριο οξυγόνο υπο πίεση P. Μεταβάλλουμε την πίεση και ζυγίζουμε το μέταλλο. Με τέτοιες μετρήσεις, παίρνουμε τον παρακάτω πίνακα τιμών για την πίεση του οξυγόνου και την μάζα που προσροφήθηκε κάθε φορά:
| P (Pa) | m (μgr) |
| 0.28 | 1.40 |
| 0.61 | 2.21 |
| 0.95 | 2.78 |
| 1.70 | 3.23 |
(α) Βρείτε αν στην επιφάνεια του σιδήρου έχουμε μοριακό ή ατομικό οξυγόνο. Για να απαντήσετε, εξετάστε αν ισχύει η εξίσωση θ=KP/(1+KP) (προσρόφηση χωρίς διάσπαση) ή η εξίσωση θ=√(K'P)/(1+√(Κ'P)) (προσρόφηση με διάσπαση). Χρησιμοποιήστε τη σχέση θ=m/m∞. Είναι καλύτερα να δουλέψουμε με σχέσεις της μορφής y=ax+b. Αν είχα μοριακό οξυγόνο, η πρώτη σχέση δίνει (P/m)=(1/m∞K)+(1/m∞)P , δηλαδή y=P/m, x=P. Αντίθετα, αν είχα ατομικό οξυγόνο, η δεύτερη σχέση δίνει (√P/m)=(1/m∞K')+(1/m∞)√P , δηλαδή y=√P/m, x=√P. Φτιάξτε τις δυο γραφικές παραστάσεις. Ποια από τις δυο μοιάζει περισότερο με ευθεία; Τι συμπεραίνετε για το είδος του προσροφημένου οξυγόνου;
(β) Από την σωστή γραφική παράσταση, αυτή δηλαδή που μοιάζει με ευθεία, υπολογίστε την παράμετρο m∞. Εξηγήστε πώς μπορύμε από την παράμετρο αυτή να υπολογίσουμε το εμβαδόν της επιφάνειας, γνωρίζοντας την απόσταση μεταξύ γειτονικών ατόμων. Κάντε τον υπολογισμό αν σας δίνεται ότι έχουμε στην επιφάνεια δομή πυκνής διάταξης με απόσταση γειτονικών ατόμων d=0.23 nm.
Θεωρήστε ότι έχουμε δυο είδη μορίων στην αέρια φάση, και συμβαίνουν ταυτόχρονα οι αντιδράσεις Α+*↔Α* και Β+*↔Β*. Υπολογίστε την εξάρτηση της επιφανειακής συγκέντρωσης του Α από τις μερικές πιέσεις των αερίων Α και Β.
Η έννοια της ενθαλπίας προσρόφησης, ΔΗAD. Οι δυο γενικές κατηγορίες προσρόφησης, φυσιρόφηση (|ΔΗAD| ~ 35 kJ/mol ή μικρότερο, ασθενείς δεσμοί τύπου Van der Waals) και χημιρρόφηση (ισχυροί χημικοί δεσμοί μεταξύ επιφάνειας και προσροφημένων μορίων). Φυσιρόφηση έχουμε σε περιπτώσεις πολύ σταθερών μορίων ή πολύ σταθερών επιφανειών.
(Attard and Barnes κεφ. 1.5.)Η σταθερά K της χημικής ισορροπίας συνδέεται με την ενθαλπία προσρόφησης μέσω της K=K0exp(-ΔGAD/RT) όπου ΔGAD= ΔHAD-ΤΔSAD είναι η διαφορά στην ελεύθερη ενέργεια Gibbs μεταξύ αέριας και προσροφημένης φάσης. Χρησιμοποιείστε τη σχέση αυτή και τη σεση του Langmuir για να δείξετε ότι lnP=ΔHAD/RT + c, όπου το c δεν εξαρτάται από τα P, T αλλά μόνο από την επιφανειακή συγκέντρωση. Αυτή η σχέση μας επιτρέπει τον προσδιορισμό της ενθαλπίας προσρόφησης μέσω πειράματος όπου μεταβάλλουμε την πίεση και τη θερμοκρασία έτσι ώστε η επιφανειακή συγκέντρωση να μένει σταθερή.
Παράδειγμα: σε ένα πείραμα τοποθετείται οξυγόνο σε πίεση 1 mbar μέσα σε ασημένιο δοχείο στους 700 Κ. Μετράμε ότι προσροφήθηκε κάποια μάζα οξυγόνου. Αν αυξήσουμε τη θερμοκρασία στους 800 Κ, απαιτείται πίεση 36 mbar για να έχουμε προσρόφηση ίδιας μάζας οξυγόνου. Μπορείτε να υπολογίσετε την ενθαλπία προσρόφησης του οξυγόνου στον άργυρο από αυτό το δεδομένο;
Οι διαδικασίες προσρόφησης και εκρόφησης (όπως και κάθε χημική αντίδραση) χαρακτηρίζονται από μια ενέργεια ενεργοποίησης (activation energy) δηλαδή το ενεργειακό φράγμα που απαιτείται να υπερπηδηθεί για να γίνει η αντίδραση, και μια θερμότητα (ενθαλπία) αντίδρασης, η οποία αντιστοιχεί στην διαφορά ενέργειας μεταξύ αντιδρώντων και προϊόντων. Είναι σημαντικό να θυμόμαστε ότι η ενέργεια ενεργοποίησης καθορίζει την ταχύτητα της αντίδρασης (k=k0exp(-Ea/RT)) ενώ η θερμότητα αντίδρασης καθορίζει την πιθανότητα να συμβεί η αντίδραση αυθόρμητα (K=K0exp(-ΔΗ/RT)).
H ενέργεια ενεργοποίησης για εκρόφηση μετριέται με την τεχνική του Temperature Programmed Desorption (TPD). Στην τεχνική αυτή (α) φέρνουμε σε επαφή, σε χαμηλή θερμοκρασία, την επιφάνεια και το αέριο υπο μελέτη (β) αφήνουμε χρόνο για να ισορροπήσει (γ) αυξάνουμε ομαλά τη θερμοκρασία: Τ=Τ0+βt, όπου β~2 K/sec. (δ) μετράμε το ρυθμό εκρόφησης (dN/dT) συναρτήσει της θερμοκρασίας.
Από τις παραπάνω σχέσεις, μπορούμε να δείξουμε ότι dN/dT=ANm/β exp(-Ed/RT). Η σταθερά Α είναι της τάξεως του 1013. Ο ακέραιος m δίνει την τάξη της αντίδρασης: m=1 αν για κάθε προσροφημένο σωμάτιο προκύπτει ένα στην αέρια φάση (πχ O2*↔O2+*) ενώ m=2 αν για κάθε δυο προσροφημένα σωμάτια προκύπτει ένα στην αέρια φάση (πχ 2O*↔O2+2*). Τι μορφή θα έχει η γραφική παράσταση του dN/dT σαν συνάρτηση της θερμοκρασίας; Αφού η ταχύτητα της αντίδρασης αυξάνεται με τη θερμοκρασία, γιατί το dN/dT μηδενίζεται σε μεγάλες θερμοκρασίες;
Μπορούμε να βρούμε την ενέργεια ενεργοποίησης με δυο κυρίως τρόπους: (α) με διάγραμμα Arrhenius του ln(dN/dT) συναρτήσει του 1/Τ, οπότε η κλίση της προκύπτουσας ευθείας θα ισούται με Ed/R. (β) χρησιμοποιώντας το μέγιστο του ρυθμού εκρόφησης. Βρείτε την εξίσωση που ικανοποιεί η θερμοκρασία Tp για την οποία ο ρυθμός εκρόφησης είναι μέγιστος. Κατά προσέγγιση, η ενέργεια ενεργοποίησης (σε kJ/mol) ισούται με το 1/4 της Tp (σε Κ).
(Attard and Barnes κεφ. 1.3 και 2.7.)Ατομική δομή επιφανειών στερεών
Η έννοια της επίπεδης και της καλά ορισμένης στερεής επιφάνειας. Ορισμός των δεικτών Miller. Ατομική δομή απλών επιφανειών πχ (100) κυβικών κρυστάλλων.Ασκήσεις: (α) Σε ένα πείραμα TPD o ρυθμός εκρόφησης ήταν 0.012, 0.137 και 1.185 για θερμοκρασία 320Κ, 340Κ και 360Κ, αντίστοιχα. Ο ρυθμός θέρμανσης ήταν 2Κ/s και η θερμοκρασία μέγιστου ρυθμού ήταν Tp=400K. Υπολογίστε την ενέργεια ενεργοποίησης για εκρόφηση.
(β) Σε χαμηλή θερμοκρασία εκτελέσαμε πείραμα προσρόφησης οξυγόνου από ένα κομμάτι κάρβουνο. Η πίεση του οξυγόνου ήταν P. Στη συνέχεια, ο θάλαμος εκκενώθηκε, και το δείγμα θερμάνθηκε έως ότου όλο το οξυγόνο εκροφηθεί από το κάρβουνο. Τέλος, μετρήσαμε σε κανονικές συνθήκες (P=1 atm, T=273 K) τον όγκο του οξυγόνου που είχε προσροφηθεί στο κάρβουνο για κάθε τιμή της πίεσης P. Ο πίνακας τιμών που βρήκαμε είναι
| P (cm Hg) | 1.0 | 3.0 | 10. |
| V (cm3) | 45.0 | 60.2 | 68.4 |
Εξηγείστε γιατί ο όγκος αυξάνεται με την πίεση. Υπολογίστε το εμβαδόν της επιφάνειας του κάρβουνου.
(Attard and Barnes κεφ. 1.8 και άσκηση 3.)- Επιφανειακή συγκέντρωση, ns: αριθμός επιφανειακών ατόμων ανά μονάδα εμβαδού.
- Πλήρωση, f: το ποσοστό του εμβαδού της επιφάνειας που καταλμβάνεται από άτομα, αν θεωρήσουμε ότι τα άτομα είναι σφαίρες με ακτίνα το μισό της μικρότερης διατομικής απόστασης.
- Αριθμός γειτόνων των επιφανειακών ατόμων.
- Αριθμός ακόρεστων δεσμών (βρίσκεται αφαιρώντας τον αριθμό των γειτόνων των επιφανειακών ατόμων από τον αριθμό γειτόνων των ομοίων ατόμων του εσωτερικού του στερεού).
- Επιφανειακή ενέργεια: το μισό της ενέργεια που απαιτείται για να κόψουμε στα δυο ένα στερεό. Η επιφανειακή ενέργεια εξαρτάται από το εμβαδόν της δημιουργηθείσας επιφάνειας και από τον προσανατολισμό της
- Επιφανειακή τάση: η επιφανειακή ενέργεια ανά μονάδα εμβαδού. Σε πολύ απλές επιφάνειες, η επιφανειακή τάση μπορεί να εκτιμηθεί από την ενέργεια συνοχής του στερεού.
- Χαλάρωση: η κίνηση ατόμων κάθετα στο επίπεδο της επιφάνειας ώστε να πλησιάσουν τα άτομα του παρακάτω επιπέδου
- Αναδόμηση: κίνηση ατόμων παράλληλα στο επίπεδο της επιφάνειας και/η αφαίρεση ή πρόσθεση ατόμων, με σκοπό την ελάτωση της επιφανειακής τάσης.
Περιγραφή επιφανειών με διανύσματα βάσης, ονοματολογία αναδομήσεων και υπερδομών (δηλαδή δομών που δημιουργούνται από προσρόφηση ατόμων ή μορίων): Έστω ότι τα διανύσματα της ιδανικής επιφάνειας είναι as και bs, και ότι τα διανύσματα της υπερδομής είναι a0 και b0.
Συμβολισμός Wood: λέμε ότι έχουμε δομή (m x n)Rφ, αν ισχύει |a0|=m|as|, |b0|=n|bs| και η γωνία μεταξύ a0 και as, όπως και η γωνία μεταξύ b0 και bs είναι φ.
Συμβολισμός πίνακα: λέμε ότι έχουμε δομή
| k | l |
| m | n |
αν ισχύει a0=k as + l bs και b0=m as + n bs.
Περίθλαση ηλεκτρονίων χαμηλής ενέργειας (Low Energy Electron Diffraction - LEED): Δείξτε ότι ηλεκτρόνιο με κινητική ενέργεια γύρω στα 10-20 eV έχει μήκος κύματος de Broglie το οποίο είναι παρόμοιο με τις διατομικές αποστάσεις στα στερεά. Η τεχνική LEED στηρίζεται σε αυτή την πληροφορία και στο γεγονός ότι ηλεκτρόνια με τέτοιες ενέργειες δεν εισχωρούν στο εσωτερικό του στερεού, και είναι μια εξαιρετικά αξιόπιστη τεχνική προσδιορισμού της περιοδικότητας επιφανειών. Δείξτε ότι έχουμε μέγιστο της περίθλασης για συγκεκριμένες γωνίες (βρείτε τις!).
'Ασκηση: στην εικόνα εμφανίζονται κάποιες υπερδομές προσροφημένου CO σε επιφάνειες του Ni. Για κάθε μια από αυτές υπολογίστε την επιφανειακή συγκέντρωση. Βρείτε τα διανύσματα βάσης για την ιδανική επιφάνεια καθώς και για την υπερδομή. Περιγράψτε την υπερδομή χρησιμοποιώντας συμβολισμό πίνακα και συμβολισμό του Wood.
(Attard and Barnes κεφ. 1.15 και 2.3.)- Εκτελούμε δυο πειράματα LEED, ένα για την καθαρή επιφάνεια και ένα για την επιφάνεια που έχει προσροφημένα μόρια
- Προσδιορίζουμε τα διανύσματα του αντιστρόφου πλέγματος a0*, b0* για την υπερδομή και as*, bs* για την καθαρή επιφάνεια.
- Βρίσκουμε τη σχέση μεταξύ των διανυσμάτων, δηλαδή τους συντελεστές στις εξισώσεις a0*=G11* as* + G12* bs* και b0*=G21* as* + G22* bs*.
- Γράφουμε τον 2x2 πίνακα G* με στοιχεία τα παραπάνω Gij*.
- Ο πίνακας που περιγράφει την υπερδομή είναι ο G=(G* -1)T, δηλαδή ο ανάστροφος του αντιστρόφου του πίνακα G*.
'Ασκηση: στην εικόνα εμφανίζονται εικόνες από πειράματα LEED για διάφορες υπερδομές που εμφανίζονται με προσρόφηση H σε διάφορες επιφάνειες του Al. Οι μαύροι κύκλοι αντιστοιχούν στο υπόστρωμα, ενώ τα x εμφανίζονται μόνο στην υπερδομή. Για κάθε περίπτωση: (α) Βρείτε τον πίνακα που περιγράφει την υπερδομή (β) Περιγράψτε (αν γίνεται) την υπερδομή με συμβολισμό Wood (γ) Σχεδιάστε μια πιθανή εικόνα της ατομικής δομής που αντιστοιχεί στην υπερδομή και (δ) υπολογίστε τη συγκέντρωση προσροφημένου υδρογόνου.
Ο ρυθμός με τον οποίο συγκρούονται τα άτομα αερίου με μια επιφάνεια δίνεται από τον τύπο του Knudsen, Z=P/√(2πmkT), όπου P είναι η πίεση του αερίου, Τ η θερμοκρασία και m η μέση μάζα των μορίων του αερίου. Με βάση αυτόν τον τύπο, μπορούμε να δείξουμε ότι σε K.Σ μια επιφάνεια θα καλυφθεί πλήρως σε μερικά nsec! Βρείτε πόση πρέπει να γίνει η πίεση ώστε να έχουμε καθαρές επιφάνειες για μερικές ώρες. Η επιστήμη επιφανειών, που απαιτεί καλά ορισμένες και καθαρές επιφάνειες, γεννήθηκε τη δεκαετία του '80, οπότε και κατασκευάστηκαν καλές συσκευές υπερυψηλού κενού (Ultra-High Vacuum, UHV).
Καλά ορισμένες και επίπεδες επιφάνειες φτιάχνονται με διάφορους τρόπους. Οι πιο συνηθισμένοι είναι με μοριακή επιταξία (για ημιαγωγούς) ή με καθάρισμα της επιφάνειας με βομβαρδισμό ιόντων Αργού υψηλής ενέργειας (~1000 eV), ακολουθούμενο από ανόπτυση.
Η φασματοσκοπία ακτίνων Χ (X-ray Photoelectron Spectroscopy, XPS), στηρίζεται στο φωτοηλεκτρικό φαινόμενο: ακτίνες Χ που πέφτουν σε μια επιφάνεια, εξάγουν ηλεκτρόνια από αυτήν. Τα ηλεκτρόνια αυτά αποροφούν μέρος της ενέργειας των φωτονίων για να βγούν από τη δέσμευση του στερεού, και η υπόλοιπη γίνεται κινητική ενέργεια σύμφωνα με την εξίσωση του Einstein, hν=K-Eb-φ, όπου v είναι η συχνότητα του φωτονίου, Eb η ενέργεια δέσμευσης του ηλεκτρονίου στο άτομο, δηλαδή η ενέργεια που απαιτείται για να φύγει το e από το άτομο, και φ είναι το έργο εξόδου του μετάλλου, δηλαδή η ενέργεια που απαιτείται για να φύγει ένα ηλεκτρόνιο σθένους από το στερεό.
Στο πείραμα μετράμε την κινητική ενέργεια των φωτοηλεκτρονίων, και από την εξίσωση Einstein βρίσκουμε την Eb. Υπολογίζουμε τον αριθμό ηλεκτρονίων που εχουν ενέργεια δέσμευσης κοντά στην Eb. Το φάσμα που πέρνουμε θα έχει έντονες, στενές κορυφές όταν η Eb συμπέσει με κάποια ατομική στάθμη. Ταυτοποιώντας τις κορυφές αυτές με γνωστές τιμές από τη βιβλιογραφία (όπως, για παράδειγμα, αυτόν τον πίνακα), μπορούμε να βρούμε τόσο ποια στοιχεία υπάρχουν στην επιφάνεια, όσο και τι ακριβώς δεσμούς σχηματίζουν. (Attard and Barnes κεφ. 2.Χ.)
Κατάλυση
Λέγοντας κατάλυση, εννοούμε την επιτάχυνση χημικών αντιδράσεων χρησιμοποιώντας μια ουσία (η οποία λέγεται καταλύτης), η οποία δεν μεταβάλλεται κατά τη διάρκεια της αντίδρασης. Η κατάλυση μπορεί να είναι ομογενής, αν ο καταλύτης βρίσκεται στην ίδια φάση με τα αντιδρώντα (πχ τα ένζυμα που μετατρέπουν το μούστο σε κρασί) ή ετερογενής, αν ο καταλύτης δεν ρίσκεται στην ίδια φάση με τα αντιδρώντα (πχ ο μεταλλικός Pt που οξειδώνει αέριο CO σε CO2 στα αυτοκίνητα). Ο καταλύτης δεν μπορεί να αλλάξει τη θερμότητα της αντίδρασης, και να κάνει πχ μια ενδόθερμη αντίδραση να γίνει εξώθερμη. Μπορεί όμως να αλλάξει τη σταθερά της χημικής ισορροπίας, και άρα την απόδοση της αντίδρασης. Η πιο σημαντική όμως ιδιότητα του καταλύτη είναι ότι αυξάνει, σηνήθως κατά πολλές τάξεις μεγέθους, την ταχύτητα της αντίδρασης, καθώς μειώνει την ενέργεια ενεργοποίησης. Για να πειστείτε, υπολογίστε το λόγο των exp(-E/RT) και exp(-E'/RT) όταν T=300 K και Ε'-Ε=1 eV ~ 100 kJ/mol.
Οι δυο βασικές αρχές της κατάλυσης είναι η αρχή του Langmuir, σύμφωνα με την οποία είναι πολύ πιθανότερο να αντιδράσουν δυο μόρια σε δυο παρά σε τρεις διαστάσεις, και η αρχή του Sabatire, σύμφωνα με την οποία οι καλύτεροι καταλύτες είναι αυτοί που έχουν μέτρια ενέργεια προσρόφησης για τα μόρια των αντιδρώντων (ούτε χαμηλή, οπότε θ~0, αλλά ούτε και υψηλή, οπότε θ*~0).
H αντίδραση Α+Β↔ΑΒ έχει σταθερά ισοροπίας Κ, ώστε PAB=KGPAPB. Παρουσία καταλύτη θα έχουμε τις παρακάτω εξισώσεις στη θερμοδυναμική ισορροπία:
| Α+*↔Α* | θA=Κ1PAθ* | (1) |
| B+*↔B* | θB=Κ2PBθ* | (2) |
| Α*+B*↔ΑB* | θABθ*=Κ3θAθΒ | (3) |
| ΑB*↔ΑB+* | θΑB=Κ4 PAB θ* | (4) |
| Αριθμοί επιφανειακών θέσεων: | θA+θΒ+θAB+θ*=1 | (5) |
| Νόμος Dalton: | PAB+PA+PB=P | (6) |
Συνδυάζοντας τις παραπάνω εξισώσεις καταλήγουμε ότι η σταθερά χημικής ισορροπίας για τη συνολική αντίδραση είναι KG=K1K2K3/K4.
Αν τώρα δεν έχουμε χημική ισορροπία αλλά έχουμε συνεχή ροή αντιδρώντων (όπως στον καταλύτη του αυτοκινήτου), οι παραπάνω εξισώσεις παύουν να ισχύουν, και πρέπει να γράψουμε ένα σύστημα διαφορικών εξισώσεων για τις ταχύτητες. Στην περίπτωση όμως που ένα βήμα είναι πολύ πιο αργό από τα άλλα, μπορούμε να θεωρήσουμε ότι η ταχύτητα της ανιδρασης ισούται με την ταχύτητα αυτού του βήματος, το οποίο λέγεται RDS (Rate-Determining Step). Επιπλέον, θεωρούμε ότι τα άλλα βήματα της αντίδρασης είναι σε ισορροπία. Στην περίπτωσή μας, το τρίτο βήμα πληροί όλες τις προϋποθέσεις για να είναι RDS αφού είναι το μόνο όπου είναι πιθανόν να υπάρχει μεγάλη ενέργεια ενεργοποίησης. Θεωρούμε λοιπόν ότι οι εξισώσεις (1), (2) , (4) και (4) ισχύουν, αλλά η (3) όχι, και ότι υ=kθAθΒ-k'θABθ*. Από τις παραπάνω εξισώσεις μπορούμε να υπολογίσουμε την ταχύτητα συναρτήσει των πιέσεων και των σταθερών.
Θέλουμε να δούμε πως εξαρτάται η ταχύτητα καταλυόμενης αντίδρασης από την πίεση. Στο παραπάνω παράδειγμα, ας υποθέσουμε ότι k/k'=2, K1=K2=1/K4=Κ και ότι έχουμε 40% απόδοση, δηλαδή PAB=0.4PA, και ότι PA=PB. Με αυτές τις προσεγγίσεις βρίσκουμε ότι η ταχύτητα (υ/k) σαν συνάρτηση της πίεσης (KP) δίνεται από αυτή τη γραφική παράσταση, υπάρχει δηλαδή μια μικρή περιοχή πιέσεων όπου ο καταλύτης έχει μέγιστη απόδοση.
Για να δούμε πως εξαρτάται η ταχύτητα καταλυόμενης αντίδρασης από τη θερμοκρασία, ας δούμε ένα ρεαλιστικό παράδειγμα, συγκεκριμένα την οξείδωση του CO σε επιφάνεια Pt(111) (παρόμοια ανιδραση γίνεται σε καταλύτες αυτοκινήτου):
| CO+*↔CO* | θCO=Κ1PCOθ* | (1) |
| 1/2O2+*↔O* | θO=√(Κ2PO2)θ* | (2) |
| CO*+O*↔CO2*+* | υ=kθCOθO-k'θCO2θ* ~ kθCOθO | (3) |
| CO2*↔CO2+* | θCO2=Κ4 PCO2 θ* ~ 0 | (4) |
| Αριθμοί επιφανειακών θέσεων: | θCO+θCO2+θO+θ*=1 | (5) |
| Νόμος Dalton: | PCO+PO+PCO2=P | (6) |
Στο συγκεκριμένο παράδειγμα, το CO2 έχει τόσο μικρή ενέργεια προσρόφησης που η συγκέντρωσή του είναι πολύ μικρότερη από τις άλλες και για αυτό την αγνοούμε στις εξισώσεις (3) και (4) παραπάνω. Σε χαμηλή θερμοκρασία, το CO θα έχει καταλάβει την πλειοψηφία των θέσεων στην επιφάνεια, αφού έχει αρκετά χαμηλότερη ενέργεια προσρόφησης από ότι το O. Μπορούμε επομένως να θεωρήσουμε ότι η (5) γίνεται θ*=1-θCO οπότε η (1) δίνει θCO=Κ1PCO και σε συνδυασμό με την (2) και την (3) δίνουν ότι υ=(σταθ.)√(PO2)/PCO. Eξηγήστε γιατί η ταχύτητα πέφτει αν αυξηθεί το CO. Σε ψηλή θερμοκρασία θα ισχύει θ*~1 και άρα υ=(σταθ.)√(PO2) PCO, δηλαδή ίδια μορφή με την ταχύτητα απουσία καταλύτη, αλλά με τεράστια διαφορά στην τιμή της σταθεράς. Aν κάναμε την πλήρη λύση των εξισώσεων θα βρίσκαμε τις παρακάτω εικόνες, οι οποίες δείχνουν και πάλι ότι για κάθε καταλύτη και για κάθε αντίδραση υπάρχει συγκεκριμένη περιοχή τιμών πίεσης και θερμοκρασίας στην οποία η απόδοση είναι βέλτιστη.
Λύσαμε την άσκηση 30 από τη σελίδα ασκήσεων, η οποία είναι η άσκηση 4 του βιβλίου των Attard and Barnes.
'Ασκηση: Υπολογίστε τη συγκέντρωση επιφανειακών ατόμων (ns) και την πλήρωση (f) για τις επιφάνειες Si(100) και Si(111). To Si σχηματίζει δομή διαμαντιού με a=0.543 nm. Εξηγείστε την παρατηρούμενη αναδόμηση (2x1) της Si(100).
H χημική αντίδραση που χρησιμοποιείται περισσότερο από οποιαδήποτε άλλη στον κόσμο είναι η σύνθεση της αμμωνίας από άζωτο και υδρογόνο, υπό υψηλες πιέσεις (100-300 bar) και χρησιμοποιώντας καταλύτες βασισμένους σε μεταβατικά μέταλλα. Η τεχνική αυτή λέγεται σύνθεση Haber-Bosch, και χρησιμοποιείται κυρίως για την παρασκευή λιπασμάτων. Η μέθοδος των Fritz Haber και Carl Bosch ευθύνεται λοιπόν, σε μεγάλο βαθμό, για την τεράστια αύξηση του πληθυσμού της γής μετά το 1920.
To Ν2 έχει τον ισχυρότερο δεσμό που γνωρίζουμε στη φύση, καθώς για να διασπαστεί απαιτούνται περίπου 950 kJ/mol. Αντίθετα, στους σύγχρονους καταλύτες, η ενέργεια ενεργοποίησης για τη διάσπαση του αζώτου είναι μόλις 70 kJ/mol. Από τα δεδομένα αυτά μπορούμε να δείξουμε ότι αν είχαμε όλο το άζωτο της γής και περιμέναμε χρόνο ίσο με την ηλικία του σύμπαντος, η πιθανότητα να συμβεί έστω και μια διάσπαση μορίου αζώτου θα ήταν 1030 φορές μικρότερη από την πιθανότητα να διασπαστεί ένα μόριο αζώτου σε ένα δευτερόλεπτο, αν χρησιμοποιούμε καταλύτη!
Η βιομηχανική σύθεση της αμμωνίας περιλαμβάνει διάφορα στάδια τα οποία καταλήγουν στην απομώνωση του αζώτου (ξεκινώντας από ατμοσφαιρικό αέρα) και του υδρογόνου (ξεκινώντας από φυσικό αέριο). Απαιτούνται μεγάλες ποσότητες νερού, τόσο για τη σύνθεση H2 από το φυσικό αέριο, με αντιδράσεις της μορφής CH4+H2O↔CO+3H2 (steam reforming), όσο και για την απομάκρυνση του παραγόμενου CO μέσω της CO+H2O↔CO2+H2 (water gas shift). Απαιτούνται επίσης τεράστιες ποσότητες ενέργειας για τη θέρμανση και συμπίεση των αερίων: το 1% της παγκόσμιας παραγωγής ενέργειας καταναλώνεται σε μονάδες σύνθεσης αμμωνίας.
'Oπως σε όλες τις διεργασίες που συμβαίνουν στη βιομηχανία, είναι πολύ χρήσιμο να έχουμε κάποιο τύπο ο οποίος να δίνει την απόδοση σαν συνάρτηση των παραμέτρων της διεργασίας. Σε καταλυτικές αντιδράσεις οι οποίες γίνονται σε αντιδραστήρες αέριας ροής, όπως ο καταλύτης του αυτοκινήτου, το ζητούμενο είναι η ταχύτητα της αντίδρασης σαν συνάρτηση της θερμοκρασίας και των μερικών πιέσεων των αντιδρώντων. Καθώς η θερμοκρασία των αερίων συνήθως επηρεάζεται από άλλους παράγοντες, το ενδιαφέρον εστιάζεται στην εξάρτηση της ταχύτητας από τις πιέσεις. Για τη διαδικασία Haber-Bosch, έχει βρεθεί ότι
υ=a (KGPN2-PNH32/PH23)/ (1+γPNH3/PH2w)2,
όπου KG είναι η σταθερά της χημικής ισορροπίας, α και γ είναι σταθερές και w αριθμός μεταξύ 0 και 1. Θα αναπαράγουμε τον τύπο αυτόν μελετώντας το μηχανισμό της αντίδρασης:
| N2+*↔N2* | θN2=Κ1PN2θ* | (1) |
| N2*+*↔2N* (RDS) | υ=k θN2θ* - (k/K2) θN2 | (2) |
| N*+H*↔NH*+* | θN=θNHθ*/(K3θH) | (3) |
| NH*+H*↔NH2*+* | θNH=θNH2θ*/(K4θH) | (4) |
| NH2*+H*↔NH3*+* | θNH2=θNH3θ*/(K5θH) | (5) |
| NH3*↔NH3+* | θNH3=(1/K6)PNH3θ* | (6) |
| H2+2*↔2H* | θH=√(Κ7 PH2) θ* | (7) |
| Αριθμοί επιφανειακών θέσεων: | θN2+θN+θNH+θNH2+θNH3+θH+θ*=1 | (8) |
Οι αρχικές, τελικές και ενδιάμεσες ενέργειες όλων των παραπάνω αντιδράσεων σε επιφάνεια Ru(001) και σε σκαλοπάτι του Ru φαίνονται στο παρακάτω σχήμα (παρμένο από το άρθρο Honkala et al., Science 307, 555 (2005)):
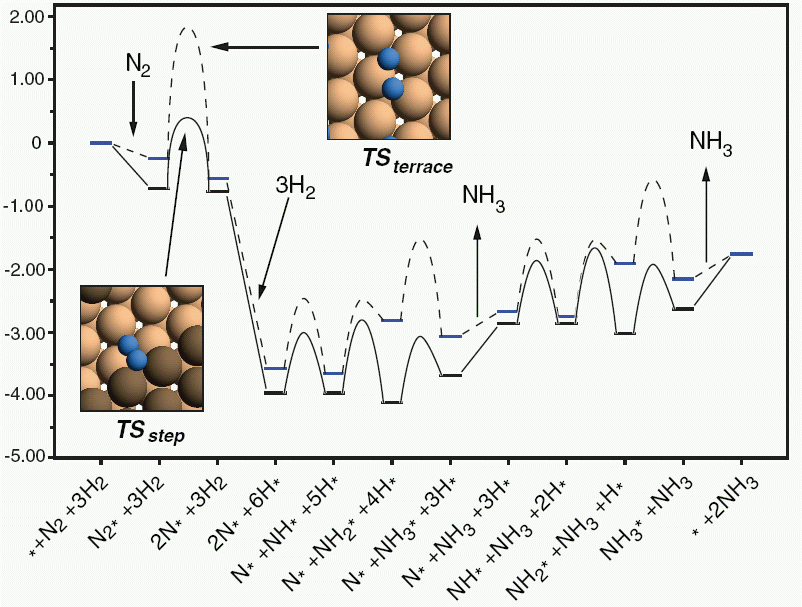
Το σχήμα δικαιολογεί πλήρως την επιλογή μας να χαρακτηρούσουμε τη διάσπαση του αζώτου ως το πιο αργό βήμα (rate determining step, RDS), αφού για να συμβεί απαιτείται περισσότερη ενέργεια από οποιοδήποτε άλλο. Οι εξισώσεις (1) έως (8) μπορούν να λυθούν ως προς τις συγκεντρώσεις, να αντικαταστήσουμε το αποτέλεσμα στην (3) και να υπολογίσουμε την ταχύτητα. Από τη λύση μπορούμε να υπολογίσουμε και τη σταθερά χημικής ισορροπίας KG=PNH32/PH23/PN2 σαν συνάρτηση των σταθερών K1 έως K7. Από το σχήμα επίσης φαίνεται ότι το ΝΗ2 έχει τη χαμηλότερη ενέργεια. Μπορούμε λοιπόν να θεωρήσουμε ότι η συγκέντρωσή του θα είναι πολύ μεγαλύτερη από ότι τα άλλα μόρια. Σε πρώτη προσέγγιση, αυτό σημαίνει να αντικαταστήσουμε την (8) με την θNH2+θ*=1, οπότε θα βρούμε ακριβώς τον παραπάνω εμπειρικό τύπο με w=1/2, α=kK1/KG και γ=1/(K5K6K7K70.5) (κάντε τις πράξεις!)
Στο παραπάνω διάγραμμα φαίνεται ότι η ενέργεια ενεργοποίησης για τη διάσπαση του μορίου του αζώτου είναι κατά 1.5 eV υψηλότερη στην ιδανική επιφάνεια Ru(001) από ότι σε ένα σκαλοπάτι του Ru. Αν σκεφτούμε ότι η ταχύτητα της αντίδρασης είναι ανάλογη του exp(-Ea/RT), καταλαβαίνουμε ότι στο σκαλοπάτι έχουμε αντίδραση που γίνεται ταχύτερα κατά πολλές τάξεις μεγέθους. Επιπρόσθετα, υπάρχει μεγάλη διαφορά ανάλογα με τον τύπο του σκαλοπατιού και τη χημική σύστασή του. Αυτές οι θέσεις της επιφάνειας του καταλύτη, στις οποίες κατά κύριο λόγο συντελείται η καταλυτική αντίδραση, λέγονται ενεργές θέσεις (active sites).
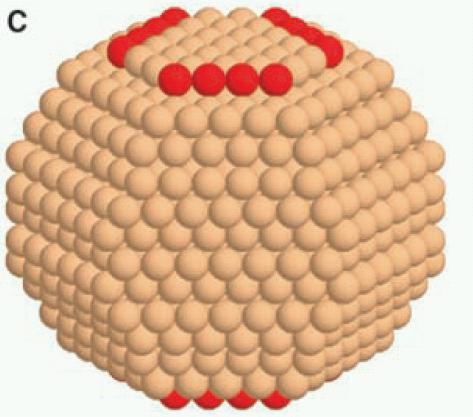
Υπάρχουν τρεις στρατηγικές για την κατασκευή καταλυτών με πολλές ενεργές θέσεις: (α) φτιάχνουμε πορώδες υλικό με μεγάλο εμβαδόν της επιφάνειάς του, ελίζοντας ότι μέσα στις πάμπολες επιφανειακές θέσεις θα υπάρξουν και αρκετές ενεργές. (β) φτιάχνουμε τραχιές επιφάνειες, ώστε να υπάρχουν αρκετά σκαλοπάτια και άλλες ατέλειες ή (γ) φτιάχνουμε νανοσωμάτια, τα οποία και μεγάλη επιφάνεια έχουν σε σχέση με τη μάζα τους, αλλά και πολλές γωνίες και ακμές στις οποίες μπορεί να εμφανιστούν ενεργές θέσεις. Η τεχνική (γ) λοιπόν αποτελεί κατά κάποιο τρόπο συνδυασμό των (α) και (β). Το παρακάτω σχήμα δείχνει πειραματική και θεωρητική (από προσομοίωση) εικόνα ενός νανοσωμάτιου Ru από καταλύτη που χρησιμοποιείται στη βιομηχανική παραγωγή αμμωνίας. Οι ενεργές θέσεις φαίνονται με κόκκινο.

'Ασκηση: Η αντίδραση CO+1/2O2↔CO2 γίνεται στον τριοδικό καταλύτη του αυτοκινήτου, και χάρη σε αυτήν δεν εκλύεται στην ατμόσφαιρα το δηλητηριώδες CO. Γράψτε το μηχανισμό της ανιδρασης. Εξηγήστε γιατί το βήμα CO*+O*↔CO2* είναι πολύ πιο αργό από οποιοδήποτε άλλο και επομένως μπορεί να θεωρηθεί ότι είναι RDS (rate-determining step). Βρείτε πώς εξαρτάται η ταχύτητα της αντίδρασης από τις μερικές πιέσεις. Δώστε ασυμπτωτικές εκφράσεις για πολύ χαμηλές και πολύ υψηλές θερμοκρασίες.
'Ασκηση: Στις κυψέλες καυσίμου χρησιμοποιείται καταλύτης Pt στον οποίο το υδρογόνο προσροφάται με διάσπαση, και εν συνεχεία τα άτομα υδρογόνου χρησιμοποιούνται για την παραγωγή ενέργειας. Το αέριο υδρογόνο όμως περιέχει και ίχνη CO, το οποίο επίσης προσροφάται στην επιφάνεια. Καθώς μάλιστα έχει μεγαλύτερη ενέργεια εκρόφησης (EdCO=100 kJ/mol ενώ EdΗ=80 kJ/mol), καταλαμβάνει τις περισότερες θέσεις στην επιφάνεια, μη αφήνοντας χώρο για το υδρογόνο. Υπολογίστε τις συγκεντρώσεις θH, θCO και θ* για P=1 bar και θερμοκρασία 80oC, όταν η περιεκτικότητα του υδρογόνου σε CO είναι (α) 1 ppm ή (β) 10 ppm ή (γ) 100 ppm. Δίνεται ότι η επιφάνεια του καταλύτη είναι Pt(111) και ο Pt έχει δομή fcc με α=0.392 nm, και οι σταθερές της ταχύτητας αντιδράσεων (ν=1013 sec-1):
| H2+2*↔2H* | k1+=2/ns√(2πmH2kBT) | k1-=v exp(-EdΗ/RT) |
| CO+*↔CO* | k2+=1/ns√(2πmCOkBT) | k2-=v exp(-EdCO/RT) |
Σχήμα των νανοσωματιδίων και επιφανειακές τάσεις
Το σχήμα των νανοσωματιδίων καθορίζεται από δυο κυρίως παράγοντες: τη συμμετρία της κρυσταλλικής δομής και τις διαφορές στην επιφανειακή τάση από επιφάνεια σε επιφάνεια. Στα νανοσωμάτια που φτιάχνονται πάνω σε υπόστρωμα, όπως στους καταλύτες, παίζει ρόλο και η διεπιφανειακή τάση. Προς το παρόν θα αγνοήσουμε αυτόν τον παράγοντα.
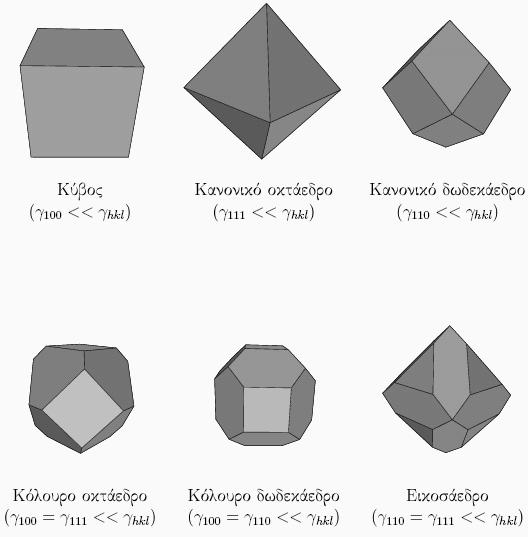
Το νανοσωματίδιο πρέπει να έχει τις ίδιες συμμετρίες που έχει και το αντίστοιχο υλικό. Για παράδειγμα, σε ένα υλικό με κυβική κρυσταλλική δομή (fcc, bcc, sc, diamond, NaCl κτλ) ο κρύσταλλος φαίνεται πανομοιότυπος αν περιστραφεί κατά 90o γύρω από τρεις άξονες, οι οποίοι είναι κάθετοι μεταξύ τους. Αυτό σημαίνει ότι επιφάνειες που είναι κάθετες μεταξύ τους έχουν ίδια δομή, και επομένως και ίδια επιφανειακή ενέργεια. Αυτό πχ συμβαίνει με τις (100), (010) και (001) οι οποίες είναι όλες ισοδύναμες σε κρυστάλλους με κυβική συμμετρία. Αντίθετα, αν ο κρύσταλλος έχει εξαγωνική συμμετρία, όπως πχ η δομή hcp, οι έδρες (100) και (001) θα είναι εν γένει πολύ διαφορετικές. Δείτε για παράδειγμα το νανοσωμάτιο του καταλύτη στο προηγούμενο μάθημα, το οποίο φτιάχθηκε από μέταλλο δομής hcp, το Ru. Η θεωρία της συμμετρίας μας επιτρέπει να αποκλείσουμε δομές για τα νανοσωμάτια. Πχ σε υλικό με κυβική συμμετρία δεν μπορεί να φτιάχνει πυραμιδοειδή νανοσωμάτια, αφού μια πυραμίδα δεν έχει τρεις κάθετους άξονες συμμετρίας, αλλά μόνο έναν. Αντίθετα, όλα τα παρακάτω σχήματα έχουν τις ίδιες συμμετρίες που έχει και ο κύβος, και άρα θα μπορούσαν να φτιαχτούν νανοσωμάτια τέτοιου σχήματος από κυβικής συμμετρίας υλικά:
Το σχήμα του νανοσωματιδίου είναι τέτοιο ώστε να ελαχιστοποιείται η επιφανειακή ενέργεια. Για δεδομένη ποσότητα του υλικού, το σύστημα θα επιλέξει το σχήμα εκείνο το οποίο ελαχιστοποιεί τη συνολική επιφανειακή ενέργεια. Η τελευταία ισούται με το άθροισμα όρων της μορφής γhklAhkl, όπου γhkl είναι η επιφανειακή τάση της επιφάνειας (hkl) και Ahkl το εμβαδόν της επιφάνειας αυτής στο νανοσωμάτιο. Το σχήμα του νανοσωματιδίου επιλέγεται ώστε το άθροισμα αυτό να έχει την ελάχιστη τιμή. Ο τρόπος που γίνεται αυτό δίνεται από το παρακάτω θεώρημα:
Θεώρημα Wulff: Το σχήμα ελάχιστης επιφανειακής ενέργειας είναι εκέινο για το οποίο dhkl/γhkl=σταθερό. dhkl είναι η απόσταση του επιπέδου hkl από το κέντρο του νανοσωματιδίου.
Εφαρμογή: σε κάποιο υλικό είναι γ100=γ110=γ-110=γ, γ010=2γ=γ001, και γhkl > 2γ για όλα τα άλλα επίπεδα. Βρείτε το σχήμα ελάχιστης ενέργειας.
Λύση: Το παρακάτω σχήμα δείχνει την κάτοψη του νανοσωματιδίου. Τοποθετούμε το επίπεδο (100), το οποίο είναι παράλληλο με το επίπεδο yz σε απόσταση 1 από την αρχή. Τοποθετούμε συμμετρικά του το (-100) (κόκκινο). Τοποθετούμε τα επίπεδο (010) και (0-10), τα οποία είναι παράλληλο με το επίπεδο xz, σε απόσταση 2 από την αρχή, αφού γ010=2γ100 (μπλέ). Το επίπεδο (110) θα είναι παράλληλο με την ευθεία x+y=0 στο επίπεδο xy, και θα απέχει επίσης 1 από την αρχή (πράσινο). Το (-110) θα είναι παράλληλο με την ευθεία -x+y=0 στο επίπεδο xy, και θα απέχει επίσης 1 από την αρχή (πράσινο). Τέλος σχεδιάζω και τα συμμετρικά τους, (-1-10) λαο (1-10). Το σχήμα του νανοσωματιδίου θα περικλείεται από τα επίπεδα που σχεδιάσαμε, και θα είναι ένα πρίσμα με εξαγωνική βάση, η οποία φαίνεται δεξιά. Δεν χρειάζεται να ανησυχούμε για άλλες έδρες, αφού η συνθήκη γhkl > 2γ υπαγορεύει ότι θα απέχουν πάνω από 2 από την αρχή και άρα δεν θα επηρεάζουν το σχήμα.
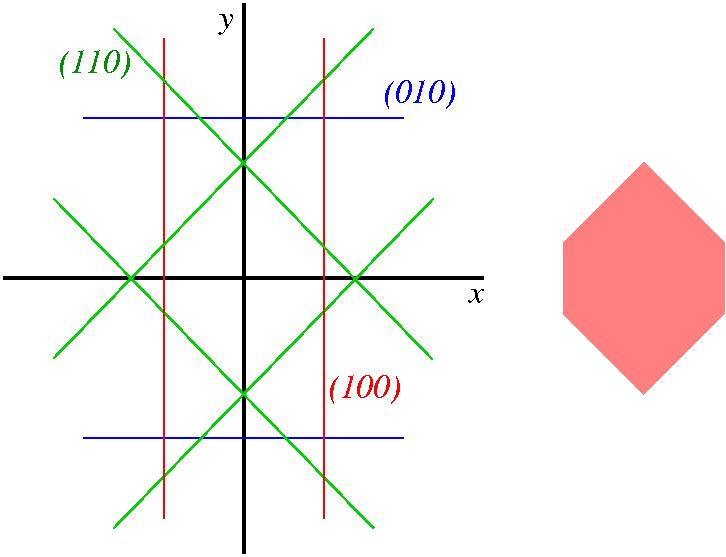
Παρατηρήσεις: (α) Το σχήμα καθορίζεται από το λόγο των επιφανειακών τάσεων. (β) Οι επιφάνειες που εμφανίζονται στο σχήμα είναι αυτή με τη χαμηλότερη γ και αυτές που έχουν γ το πολύ 1.5 φορά περίπου μεγαλύτερο από το ελάχιστο. (γ) Επιφάνειες με δείκτες Miller μεγαλύτερους του 2 σπάνια πάιζουν ρόλο στο σχήμα (μεγάλη γ λόγω σκαλοπατιών).
Για να προσδιορίσουμε το σχήμα ελάχιστης ενέργειας για ένα υλικό ή νανοϋλικό, πρέπει να γνωρίζουμε τις συμμετρίες του και τις επιφανειακές τάσεις για διάφορες έδρες. Καθώς είδαμε, αρκεί να κοιτάξουμε επιφάνειεσ με δείκτες Miller 0 ή 1, αφού επιφάνειες με μεγάλους δείκτες έχουν ψηλή επιφανειακή τάση. Ο πιο απλός τρόπος να εκτιμήσουμε τις επιφανειακές τάσεις είναι να θεωρήσουμε ότι προέρχονται από τους δεσμούς που μένουν ακόρεστοι (dangling bonds) καθώς κόβουμε το υλικό για να σχηματίσουμε την επιφάνεια. Αν σε εμβαδόν Α έχουμε Ν άτομα με Ndb ακόρεστους δεσμούς έκαστο, και η ενέργεια κάθε ακόρεστου δεσμού είναι Edb, μπορούμε να εκτιμήσουμε την επιφανειακή ενέργεια από την γ=Ν Ndb Edb/Α. Η ενέργεια του ακόρεστου δεσμού μπορεί να εκτιμηθεί από την ενέργεια συνοχής, η οποία είναι η ενέργεια που απαιτείται για να διαλυθεί το στερεό στις δομικές του μονάδες. Αν κάθε άτομο του στερεού έχει z κοντινότερους γείτονες, τότε θα είναι Edb=Ec/z.
Εφαρμογή: Χρησιμοποιείστε την παραπάνω ιδέα για να καταλάβετε το σχήμα νανοσωματιδίων αργύρου, τα οποία βρέθηκαν στο πείραμα να έχουν σχήμα κύβου με στρογγυλεμένες γωνίες. Δείτε το πείραμα και τη λύση εδώ.
'Ασκηση: εκτιμήστε το σχήμα ελάχιστης ενέργειας για νανοσωμάτια υλικού που έχει τη δομή του διαμαντιού. Απάντηση: Εργαζόμενοι όπως στο παράδειγμα του Ag, βρίσκουμε ότι γ100=Ec/a2, όπου Ec η ενέργεια συνοχής και a η πλεγματική σταθερά. Επίσης ότι γ110=(1/√2)Ec/a2 και γ111=(1/√3)Ec/a2. Βρήκαμε λοιπόν ότι η (111) έχει χαμηλότερη επιφανειακή τάση από όλες τις επιφάνειες του διαμαντιού, με την (110) λίγο ψηλότερα. Επομένως το σχήμα θα είναι έιτε κανονικό οκτάεδρο (δείτε την εικόνα παραπάνω) είτε εικοσάεδρο, αλλά με τις τριγωνικές έδρες που αντιστοιχούν στην (111) να είναι αρκετά μεγαλύτερες από τις εξαγωνικές, οι οποίες αντιστοιχούν στην (110). Για να απαντήσουμε στο ερώτημα αν θα εμφανιστούν οι (110) έδρες, χρειάστηκε να αποδείξουμε την παρακάτω πρόταση:
Σε υλικό με κυβική συμμετρία και γ111 > γ110 > γhkl για όλα τα άλλα (hkl), το σχήμα είναι κανονικό οκάεδρο, εκτός εάν συμβεί να είναι γ111/γ110 > √2/√3.
Στην περίπτωσή μας η ανισότητα ισχύει οριακά. Αποδείξαμε επομένως ότι τα στερεά δομής διαμαντιού έχουν σχήμα ελάχιστης ενέργειας το κανονικό οκτάεδρο, το οποίο εξάλλου γνωρίζουμε ότι είναι και το σύνηθες σχήμα που έχουν τα διαμάντια.
Στην περίπτωση που το υλικό δεν είναι σε ομοιγενές περιβάλλον, αλλά συγκρατείται πάνω σε μια επιφάνεια, το σχήμα του καθορίζεται από το συνδυασμό των επιφανειακών τάσεων αλλά και της διεπιφανειακής τάσης μεταξύ του υλικού και της επιφανειας. Νανοσωμάτια που συγκρατούνται πάνω σε επιφάνειες θα προσπαθήσουν είτε να έχουν μεγάλο εμβαδόν της διεπιφάνειας, εαν συμβεί η διεπιφάνεια να έχει χαμηλότερη ενέργεια από την επιφάνεια του υποστρώματος. Στην αντίθετη περίπτωση το εμβαδόν της διεπιφάνειας θα είναι μικρό. Η συνάφεια μεταξύ του υλικού και του υποστρώματος αντικατοπτρίζεται στη γωνία επαφής (contact angle), θ. Στην περίπτωση μεγάλης συνάφειας, η γωνία επαφής είναι οξεία, ενώ στην περίπτωση μικρής συνάφειας είναι αμβλεία. Για παράδειγμα, η παρακάτω εικόνα δείχνει διάφορες γωνίες επαφής για διεπιφάνεια μεταξύ μιας σταγόνας νερού και διαφόρων πολυμερικών υποστρωμάτων.
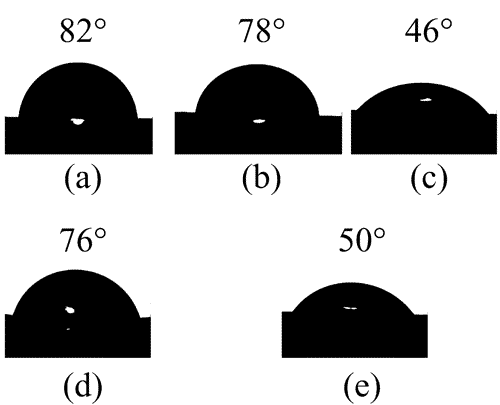
Η σχέση γωνίας επαφής και διεπιφανειακής τάσης δίνεται από τον τύπο του Young, γ2=γint+γ1cosθ, όπου γ2 είναι η επιφανειακή τάση του υποστρώματος, γ1 η επιφανειακή τάση του υλικού ή του νανοσωματιδίου, γint η διεπιφανειακή τάση και θ η γωνία επαφής. Οι επιφάνειες των υγρών ασκούν δύναμη παράλληλη προς αυτές με μέτρο F=γL, όπου γ είναι η επιφανειακή τάση και L το μήκος της επιφάνειας κάθετα στην κατεύθυνση του F. Η επιφανειακή τάση εκφράζει την απροθυμία των υγρών να αυξήσουν το εμβαδόν της επιφάνειάς τους.
'Ασκηση: Ρίχνουμε μια σταγόνα νερού σε επιφάνεια υδραργύρου και παρατηρούμε ότι η γωνία επαφής ήταν 33.3o. Η επιφανειακή τάση του νερού είναι 0.073 J/m2 και του υδραργύρου 0.436 J/m2. Βρείτε τη διεπιφανειακή τάση. 'Ασκηση: Βρείτε τι σχήμα θα πάρει μια σταγόνα βενζίνης πάνω σε επιφάνεια νερού. Η επιφανειακή τάση της βενζίνης και του νερού είναι 0.029 J/m2 και 0.073 J/m2, αντίστοιχα, και η διεπιφανειακή τους τάση είναι 0.035 J/m2. Καθώς η βενζίνη ανακατεύεται με το νερό, η επιφανειακή τάση του νερού μειώνεται στα 0.062 J/m2. Επαναλάβετε τον υπολογισμό.
